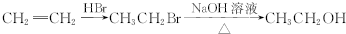题目内容
9.已知某金属硝酸盐,在受热分解时生成了金属氧化物、二氧化氮与氧气.测得产物中NO2与O2的体积比为5:1(同温同压下测得),试分析该硝酸盐分解时金属化合价的变化情况是( )| A. | 升高 | B. | 降低 | C. | 不变 | D. | 不能确定 |
分析 某金属的硝酸盐受热分解生成NO2、O2和某金属氧化物,氮元素化合价由+5价降低为+4价,氧元素化合价由-2价升高为0价,根据NO2和 O2的分子体积比为5:1,即其分子数之比为5:1,计算氮原子得到的电子、氧原子失去的电子.根据电子转移守恒,判断金属元素化合价变化.
解答 解:某金属的硝酸盐受热分解生成NO2、O2和某金属氧化物,氮元素化合价由+5价降低为+4价,氧元素化合价由-2价升高为0价,根据NO2和 O2的分子体积比为5:1,即其分子数之比为4:1,令NO2和 O2的分子个数分别为5、1,氮原子得到的电子数为5,氧原子失去的电子为1×2×[0-(-2)]=4,二者得失电子数目不相等,根据电子转移守恒,金属元素应失去电子,金属元素的化合价升高,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
19.下列各组物质沸点大小关系正确的是( )
①CH3CH2CH2OH>CH3(CH2)2CH3
②CH3(CH2)2CH3>CH3CH(CH3)2
③苯酚>苯
④CH3CH2Br>CH3CH2OH
⑤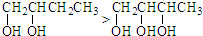
①CH3CH2CH2OH>CH3(CH2)2CH3
②CH3(CH2)2CH3>CH3CH(CH3)2
③苯酚>苯
④CH3CH2Br>CH3CH2OH
⑤
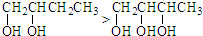
| A. | ①④ | B. | ②④⑤ | C. | ①②③ | D. | ③④⑤ |
20.下列有关化学实验的叙述正确的是( )
| A. | 用待测液润洗滴定用的锥形瓶 | |
| B. | 常温下,某同学用pH试纸测得KCl溶液的pH约为7.0 | |
| C. | 配制Fe2(SO4)3溶液时,先把Fe2(SO4)3晶体溶于浓硫酸后稀释 | |
| D. | 用碱式滴定管准确移取KMnO4溶液,体积为21.50mL |
17.下列说法不正确的是( )
| A. | 一定温度和压强下,气态物质的体积主要由构成气体的分子的大小决定 | |
| B. | 从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液中氢离子的浓度为4mol/L | |
| C. | 同温同压下,30mLA2气体和10mL B2气体恰好完全反应生成20mLC气体,则C化学式为 A3 B或B A3 | |
| D. | 同温同压下任何气体的分子间距离几乎相等 |
14.下列叙述中错误的是( )
| A. | 相同体积的任何气体都含有相同数目的分子 | |
| B. | 标准状况下,5L H2S气体与5L NH3的原子个数比为3:4. | |
| C. | 同温同压下相同体积的N2气和CO气体有相同物质的量、相同的质量和相同的对空气的密度 | |
| D. | 相同温度下,气体的压强比等于气体体积的反比 |
1.下列描述中正确的是( )
| A. | CS2为V形的极性分子 | |
| B. | ClO3- 的空间构型为平面三角形 | |
| C. | SF6中S原子和氟原子均满足最外层8电子稳定结构 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形 |
18.CuSO4•5H2O是配合物,显蓝色,其溶液加入NH3后变深蓝,加入乙醇后有晶体析出,则下列说法不正确的是( )
| A. | H2O作配体时,Cu与H2O形成σ键 | B. | H2O的配位能力大于NH3 | ||
| C. | 乙醇可减小离子晶体的溶解度 | D. | Cu(NH3)4SO4遇BaCl2有白色沉淀生成 |
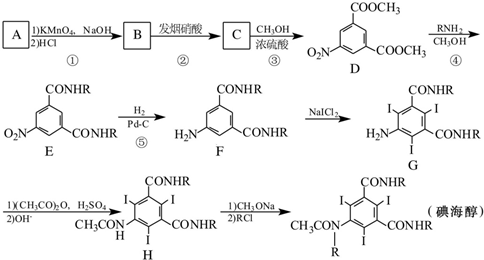
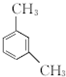 .
. 、
、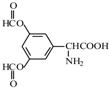 .
.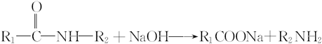
 呈弱碱性,易被氧化
呈弱碱性,易被氧化 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体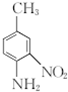 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: