题目内容
7.(1)氯化铁水解的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为Fe3++3HCO3-=Fe(OH)3↓+3CO2↑.(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置.可以观察到的现象是白色沉淀转变为红褐色沉淀.产生该现象的原因是Fe(OH)3溶度积(或Ksp或溶解度)比Mg(OH)2更小;Fe(OH)3溶度积(或溶解度)比Mg(OH)2更小.
(3)25℃,向100mL pH=12的NaOH溶液加入pH=10的NaOH溶液1000mL,混合后溶液体积1100mL,pH=11.
(4)常温下,将0.1000mol L-1 NaOH溶液滴入20.00mL 0.1000mol L-1的一元弱酸HA溶液中,刚好完全反应,则c(Na+)> c(A-).(填“>”、“<”或“=”)
(5)某有机物结构为
 ,它的含氧官能团名称为羧基、羟基.
,它的含氧官能团名称为羧基、羟基.
分析 (1)氯化铁溶液显酸性,是铁离子水解的结果,氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,说明碳酸氢根离子和铁离子水溶液中发生双水解促进反应进行彻底;
(2)依据沉淀转化的原理分析,反应向更难溶的方向进行;
(3)先计算碱人员占氢氧根离子浓度,依据体积换算得到氢氧根离子物质的量,计算混合溶液中氢氧根离子浓度,利用离子积常数计算氢离子浓度得到溶液PH;
(4)将0.1000mol L-1 NaOH溶液滴入20.00mL 0.1000mol L-1的一元弱酸HA溶液中,刚好反应,需要氢氧化钠溶液20ml,得到NaA溶液,A-离子水解分析离子浓度;
(5)依据有机物分子结构分析官能团名称.
解答 解:(1)氯化铁溶液显酸性,是铁离子水解的结果,反应的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,说明碳酸氢根离子和铁离子水溶液中发生双水解反应生成氢氧化铁沉淀和二氧化碳气体,反应的离子方程式为Fe3++3HCO3-=Fe(OH)3↓+3CO2↑,
故答案为:Fe3++3H2O?Fe(OH)3+3H+;Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置.可以观察到白色沉淀转变为红褐色沉淀,说明氢氧化铁溶解度小于氢氧化镁沉淀,
故答案为:Fe(OH)3溶度积(或Ksp或溶解度)比Mg(OH)2更小;Fe(OH)3溶度积(或溶解度)比Mg(OH)2更小;
(3)25℃,向100mL pH=12的NaOH溶液加入pH=10的NaOH溶液1000mL,PH=12溶液中氢氧根离子浓度=10-2mol/L,PH=10的溶液中氢氧根离子浓度=10-4mol/L,混合后溶液体积1100mL,混合溶液中氢氧根离子浓度=$\frac{1{0}^{-2}×0.1L+1{0}^{-4}×1L}{1.1L}$=10-3mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-3}}$=10-11mol/L,pH=11,
故答案为:11;
(4)常温下,将0.1000mol L-1 NaOH溶液滴入20.00mL 0.1000mol L-1的一元弱酸HA溶液中,刚好反应,需要氢氧化钠溶液20ml,得到NaA溶液,A-离子水解,c(Na+)>c(A-),
故答案为:>;
(5) 分子中含有含氧官能团名称为羟基、羧基,故答案为:羟基、羧基.
分子中含有含氧官能团名称为羟基、羧基,故答案为:羟基、羧基.
点评 本题考查了盐类水解的分析应用,沉淀溶度积常数大小分析、酸碱反应溶液酸碱性分析判断和溶液PH计算,掌握基础是关键,题目难度中等.

| A. | 氢气球发生爆炸 | B. | 向污染的河水中投放生石灰 | ||
| C. |  | D. |  |
| A. | 14C: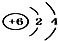 | B. | 16O: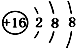 | C. | Li+: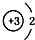 | D. | H-: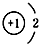 |
| A. | 高分子分离膜应用于食品工业中,可用来浓缩天然果汁、乳制品加工、酿造业等 | |
| B. | 复合材料一般是以一种材料做基体,另一种材料作为增强剂 | |
| C. | 合成高分子材料制成的人工器官一般都受到人体的排斥,难以达到生物相容的程度 | |
| D. | 导电塑料是应用于电子工业的一种新型有机高分子材料 |
| A. | 向KAl(SO4)2溶液中加入Ba(OH)2至SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| B. | 偏铝酸钠溶液中加过量HCl:AlO2-+4H+=Al3++H2O | |
| C. | 向NH4HSO3溶液中滴入适量NaOH溶液:HSO3-+OH-=SO32-+H2O | |
| D. | 电镀铜时阳极反应为:Cu2++2e-=Cu |
| A. | 1,2-二溴乙烷和1,1-二氯丙烷 | B. | 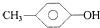 和 和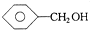 | ||
| C. | CH3CH2CH2COOH和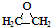 | D. | 丙炔和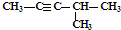 |
①CH3CH2CH2OH>CH3(CH2)2CH3
②CH3(CH2)2CH3>CH3CH(CH3)2
③苯酚>苯
④CH3CH2Br>CH3CH2OH
⑤
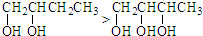
| A. | ①④ | B. | ②④⑤ | C. | ①②③ | D. | ③④⑤ |
| A. | 氧化物:CuO、NO、SO2、H2O | |
| B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | |
| C. | 碱性氧化物:Na2O、CaO、Al2O3、Na2O2 | |
| D. | 电解质:KNO3、Cl2、HCl、BaSO4 |
| A. | 一定温度和压强下,气态物质的体积主要由构成气体的分子的大小决定 | |
| B. | 从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液中氢离子的浓度为4mol/L | |
| C. | 同温同压下,30mLA2气体和10mL B2气体恰好完全反应生成20mLC气体,则C化学式为 A3 B或B A3 | |
| D. | 同温同压下任何气体的分子间距离几乎相等 |