题目内容
【题目】已知H3BO3是一元酸,室温时,用1.0mol·L-1的NaOH溶液滴定25.00mL H3BO3溶液的曲线如图所示:
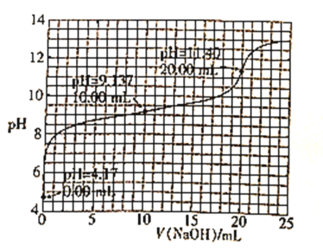
下列说法正确的是( )
A.可用酚酞作滴定指示剂
B.起始时H3BO3的浓度为0.8mol·L-1
C.H3BO3的电离常数数量级为10-5
D.滴定至pH=12时,溶液中:c(OH-)<c(H3BO3)+c(H+)
【答案】B
【解析】
由图像可知当NaOH溶液体积为20mL时,溶液的pH发生突变,此时的反应按化学计量数之比反应,从而可算出H3BO3的浓度,根据起点进一步判断出该酸的强弱和计算出其电离平衡常数。pH=12时,根据电荷守恒和物料守恒可判断溶液中离子浓度的大小关系。
A. 酚酞的变色范围为8~10,由图可知NaOH滴定H3BO3时pH在11.40左右才发生突变,酚酞的变色范围不在pH 的突变范围内,故不能用酚酞作指示剂,A错误;
B. 由分析可知当NaOH加入的体积为20mL时,酸碱恰好完全反应,且H3BO3为一元酸,故n(NaOH)=n(H3BO3),20mL×1mol/L=25mL×c(H3BO3),解得c(H3BO3)=0.8mol/L,B正确;
C. 根据曲线的起点可知H3BO3电离出的H+浓度为10-4.17mol/L,则电离出的B(OH)4-的浓度也为10-4.17mol/L,平衡时H3BO3的浓度为0.8mol/L-10-4.17mol/L≈0.8mol/L,所以K=(10-4.17)2÷0.8=5.7×10-9,数量级为10-9,C错误;
D. 当pH=12时,加入的NaOH的物质的量大于H3BO3的物质的量,
故有c(Na+)>c[B(OH)4-]+c(H3BO3),再根据电荷守恒有c(Na+)+c(H+)= c[B(OH)4-]+c(OH-),联立上述两个式子可得c(OH-)>c(H3BO3)+c(H+),D错误;
答案选B。

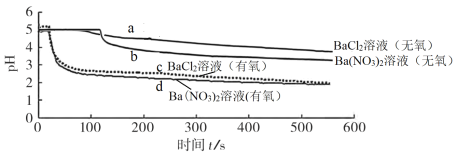
【题目】将SO2分别通入无氧、有氧的浓度均为0.1 mol·L-1的 BaCl2溶液和Ba(NO3)2溶液中,探究体系中微粒间的相互作用,实验记录如下:
实验记录 | |
pH变化 |
|
溶液中是否产生沉淀 | BaCl2溶液(无氧)中无白色沉淀、BaCl2溶液(有氧)中有白色沉淀 Ba(NO3)2溶液(无氧)中有白色沉淀、Ba(NO3)2溶液(有氧)中有白色沉淀 |
下列说法不正确的是
A.曲线a 所示溶液pH降低的原因:SO2 + H2O![]() H2SO3
H2SO3![]() H+ + HSO3-
H+ + HSO3-
B.曲线c 所示溶液中发生反应:2Ba2+ + O2 + 2SO2 + 2H2O =2BaSO4↓+ 4H+
C.与曲线a、b、c对比,可知曲线d所表示的过程中NO3-是氧化SO2的主要微粒
D.依据该实验预测0.2 mol·L-1的KNO3溶液(无氧)也可以氧化SO2
【题目】800℃时,三个相同的恒容密闭容器中发生反应CO(g) + H2O(g)![]() CO2(g) + H2(g) K,一段时间后,分别达到化学平衡状态。
CO2(g) + H2(g) K,一段时间后,分别达到化学平衡状态。
容器编号 | 起始浓度/(mol·L1) | |||
c(CO) | c(H2O) | c(CO2) | c(H2) | |
Ⅰ | 0.01 | 0.01 | 0 | 0 |
Ⅱ | 0 | 0 | 0.01 | 0.01 |
III | 0.008 | 0.008 | 0.002 | 0.002 |
下列说法不正确的是
A.Ⅱ 中达平衡时,c(H2)=0.005 mol·L1
B.III中达平衡时,CO的体积分数大于25%
C.III中达到平衡状态所需的时间比 Ⅰ 中的短
D.若III中起始浓度均增加一倍,平衡时c(H2)亦增加一倍