题目内容
【题目】mA(g)+nB(g)![]() pC(g)△H<0,室温条件下,在一容积不变的密闭容器中加入一定量的A、B,B%与压强(P)的关系如图所示,则下列有关叙述正确的是( )
pC(g)△H<0,室温条件下,在一容积不变的密闭容器中加入一定量的A、B,B%与压强(P)的关系如图所示,则下列有关叙述正确的是( )
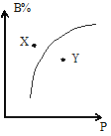
A.m+n>p
B.n>p
C.X点时混合物的正反应速率小于逆反应速率
D.X点比Y点混合物的反应速率慢
【答案】D
【解析】
曲线上的点都是平衡点,由图可知,压强越大,B的百分含量越高,说明增大压强平衡向逆反应移动;X点B的百分含量高于相同压强平衡点的含量,说明X点未到达平衡状态,反应向正反应移动,Y点B的百分含量低于相同压强平衡点的含量,说明Y点未到达平衡状态,反应向逆反应移动。
A、压强越大,B的百分含量越高,说明增大压强平衡向逆反应移动,故m+n<p,故A错误;
B、压强越大,B的百分含量越高,说明增大压强平衡向逆反应移动,故m+n<p,故B错误;
C、X点B的百分含量高于相同压强平衡点的含量,说明X点未到达平衡状态,反应向正反应移动,所以正反应速率大于逆反应速率,故C错误;
D、X点比Y点的压强小,所以X点比Y点混合物的反应速率慢,故D正确;
故选D。

【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 比较Cl2与H2SO4氧化性强弱 | 向漂白粉中加入4mol·L-1硫酸,观察有无黄绿色气体 |
B | 向浓度均为0.10molL-1的KCl和KI混合溶液中滴加少量AgNO3稀溶液,出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3- |
D | 向苯酚钠溶液中通入CO2,溶液变浑浊 | 结合H+能力: C6H5O->CO32- >HCO3- |
A.AB.BC.CD.D






