题目内容
【题目】800℃时,三个相同的恒容密闭容器中发生反应CO(g) + H2O(g)![]() CO2(g) + H2(g) K,一段时间后,分别达到化学平衡状态。
CO2(g) + H2(g) K,一段时间后,分别达到化学平衡状态。
容器编号 | 起始浓度/(mol·L1) | |||
c(CO) | c(H2O) | c(CO2) | c(H2) | |
Ⅰ | 0.01 | 0.01 | 0 | 0 |
Ⅱ | 0 | 0 | 0.01 | 0.01 |
III | 0.008 | 0.008 | 0.002 | 0.002 |
下列说法不正确的是
A.Ⅱ 中达平衡时,c(H2)=0.005 mol·L1
B.III中达平衡时,CO的体积分数大于25%
C.III中达到平衡状态所需的时间比 Ⅰ 中的短
D.若III中起始浓度均增加一倍,平衡时c(H2)亦增加一倍
【答案】B
【解析】
利用反应CO(g) + H2O(g)![]() CO2(g) + H2(g),采用一边倒的方法将生成物全部转化为反应物,各反应物的浓度分别相等(都为0.01mol/L),则表明相同温度下、三个相同的恒容密闭容器中的平衡为等效平衡,达到平衡时各组分的浓度分别对应相等;容器Ⅰ中,可利用已知数据,并假设CO的浓度变化量为x,建立以下三段式:
CO2(g) + H2(g),采用一边倒的方法将生成物全部转化为反应物,各反应物的浓度分别相等(都为0.01mol/L),则表明相同温度下、三个相同的恒容密闭容器中的平衡为等效平衡,达到平衡时各组分的浓度分别对应相等;容器Ⅰ中,可利用已知数据,并假设CO的浓度变化量为x,建立以下三段式:
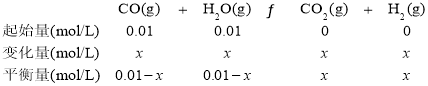
K=![]() =1,解得x=0.005mol/L。
=1,解得x=0.005mol/L。
A.Ⅱ与Ⅰ为恒温恒容下的等效平衡,所以达平衡时,c(H2)=x=0.005 mol·L1,A 正确;
B.III中达平衡时,CO物质的量浓度为0.005mol/L,CO的体积分数为![]() =25%,B不正确;
=25%,B不正确;
C.III可以看成是 Ⅰ 中反应进行的某个阶段,所以达到平衡状态所需的时间比 Ⅰ 中的短,C正确;
D.若III中起始浓度均增加一倍,即相当于加压(气体体积变为原来的一半),由于反应前后气体分子数相等,所以平衡不移动,平衡时c(H2)亦增加一倍,D正确;
故选B。

 同步练习强化拓展系列答案
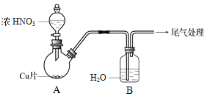
同步练习强化拓展系列答案【题目】化学小组探究铜与硝酸反应的快慢及产物。
(1)实验甲:将铜片放入盛有稀HNO3的试管中,开始无明显现象,后逐渐有小气泡生成,该气体是______。在液面上方出现浅红棕色气体,溶液呈蓝色。
(2)实验乙:铜与浓HNO3反应,装置、现象如下:
实验装置 | 实验现象 |
| A中:最初反应较慢,随后加快,反应剧烈;产生红棕色气体;溶液呈绿色。 B中:溶液呈淡蓝色。 |
①A中铜与浓HNO3产生红棕色气体的化学方程式是 ______。
②实验现象“最初反应较慢,随后加快”的原因可能是 ______。
(3)有文献记载:铜与浓HNO3反应一旦发生就变快,是因为开始生成的NO2溶于水形成HNO2(弱酸,不稳定),它再和Cu反应,反应就加快。实验探究如下:
I:向 1 mL浓硝酸中加入几滴30% H2O2溶液、铜片,反应较慢,溶液呈蓝色。
II:向1 mL浓硝酸中加入几滴30% H2O2溶液,无明显变化。
①I中反应变慢的原因是 ______。
②NO2与H2O反应生成HNO2和 ______。
③对生成HNO2后反应变快的原因进行实验探究。
序号 | 实验操作 | 实验现象 |
III | 取B中溶液,加入一定量固体,再加入铜片 | 立即产生无色气体;液面上方呈红棕色 |
IV | 取B中溶液,放置一段时间,溶液变为无色后,再加入铜片 | 产生无色气体,较Ⅲ慢;液面上方呈浅红棕色 |
a.III中加入的固体为______。
b.IV中“放置一段时间”的目的是 ______。
实验III、IV可以说明,HNO2氧化Cu的反应速率比HNO3氧化Cu的反应快。
(4)化学小组同学结合实验甲、乙中HNO3被还原后的气体产物以及实验III的产物,综合上述实验,分析判断甲中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是 ______。