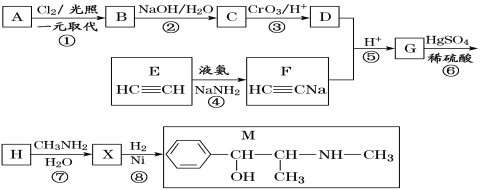
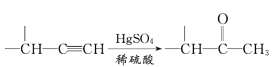
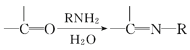
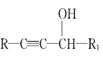题目内容
【题目】在下图所示装置中加入一定量的铁粉,分液漏斗中加入一定体积浓度为12 mol·L-1的硝酸,加热打开分液漏斗的活塞,使其充分反应后,
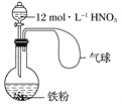
下列微粒:①![]() 、② Fe3+、③H+、④ NO、⑤ NO2,在该装置中一定大量存在的( )
、② Fe3+、③H+、④ NO、⑤ NO2,在该装置中一定大量存在的( )
A.①B.①⑤C.②④⑤D.①②③⑤
【答案】B
【解析】
12 mol·L-1的HNO3为浓硝酸,反应生成的为NO2,从下边几个角度
(1)铁过量,则反应方程式为:Fe+6HNO3=Fe(NO3)3+3NO2↑+3H2O,2Fe(NO3)3+Fe=3Fe(NO3)2,最后剩余的离子是Fe2+和![]() ;
;
(2)硝酸过量,则反应方程式为Fe+6 HNO3=Fe(NO3)3+3NO2↑+3H2O,最后剩余的离子是Fe3+、H+和![]() ;
;
(3)铁与硝酸都消耗完,则反应方程式为:Fe +6 HNO3=Fe(NO3)3+3NO2↑+3H2O,2Fe(NO3)3+Fe=3 Fe(NO3)2,铁被消耗完,而Fe(NO3)3有剩余,最后剩余的离子为Fe2+、Fe3+、![]() 。
。
根据题目分析的三种情况,可以得出:一定大量存在的是①![]() 和⑤NO2,故答案B正确。
和⑤NO2,故答案B正确。

练习册系列答案
相关题目