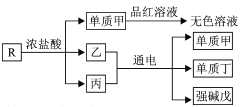
题目内容
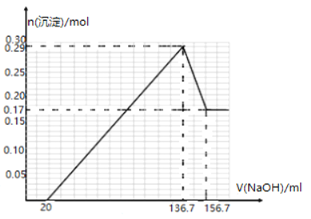
【题目】某镁铝合金MgxAly(其中x、y为整数)是贮氢材料,可在通入氩气的条件下,将一定化学计量比的Al、Mg单质在一定温度下熔炼制得.为测定该合金的成分,称取一定质量的样品放入600mL稀硫酸中,样品全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与NaOH溶液的体积关系如图所示.完成下列问题:
(1)熔炼制取镁铝合金(MgxAly)时通入氩气的目的是_____________。
(2)NaOH溶液的物质的量浓度为____________。
(3)该镁铝合金(MgxAly)的化学式为_____________。
(4)该合金在一定条件下吸氢的化学方程式为:MgxAly+xH2═xMgH2+yA1,得到的混合物在6.0mol·L-1HCl溶液中能完全释放出H2,1mol MgxAly完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量为__________________。
(5)将该镁铝合金置于NaOH溶液可以构成原电池,写出负极发生的反应_____________________。
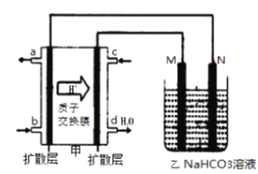
(6)如图甲为甲醇燃料电池,乙池为铝制品表面“钝化”装置,两极分别为铝制品和石墨.M电极的材料是_________________。
【答案】防止镁铝被空气氧化 6mol·L﹣1 Mg17Al12 52mol Al+4OH﹣﹣3e﹣=AlO2﹣+2H2O Al
【解析】
(1)金属镁和铝容易被氧气氧化,进入氩气可以防止镁铝被氧化;
(2)根据图2加入136.7mL氢氧化钠溶液时恰好生成0.29mol氢氧化铝和氢氧化铝沉淀,加入156.7mL氢氧化钠溶液时,沉淀被溶解的为氢氧化铝,据此可以计算出氢氧化铝、氢氧化铝的物质的量,根据质量守恒可知镁铝的物质的量之比;
(3)根据氢氧化铝与氢氧化钠反应的方程式及氢氧化铝的物质的量、氢氧化钠的体积计算出氢氧化钠的浓度;
(4)释放出的H2包括Mg17Al12吸收的氢,还包括镁、铝和盐酸反应生成的氢气;
(5)镁铝合金置于NaOH溶液构成原电池,总反应为![]() ,Al失去电子发生氧化反应为负极;
,Al失去电子发生氧化反应为负极;
(6)由装置图可知,b极通入气体后产生气体,c极通入气体后产生水,故b极通入为甲醇,c极通入的是氧气,原电池负极发生氧化反应,正极反应还原反应,所以b为正极,c为负极,M连接的为电源正极,则M为阳极,Al在阳极放电;
(1)熔炼制取镁铝合金(MgxAly)时通入氩气的目的是防止镁铝被空气中的氧气氧化,
故答案为:防止镁铝被空气氧化;
(2) 溶解0.12mol氢氧化铝消耗氢氧化钠的体积为:(156.7136.7)mL=20mL,根据反应方程式![]() 可知,氢氧化钠的物质的量浓度为:
可知,氢氧化钠的物质的量浓度为:![]() ,
,
故答案为:6mol·L﹣1;
(3) 氢氧化镁和氢氧化铝总物质的量为:0.29mol,加入过量氢氧化钠溶液后,剩余的0.17mol沉淀为氢氧化镁,则氢氧化铝沉淀的物质的量为0.12mol,根据质量守恒定律可知,原合金中镁和铝的物质的量之比为:0.17mol:0.12mol=17:12,所以该镁铝合金(MgxAly)的化学式为:Mg17Al12,
故答案为:Mg17Al12;
(4)1mol Mg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,1mol Mg17Al12完全反应生成氢气的物质的量分别为地17mol、18mol,则生成氢气一共(17+17+18)mol=52mol,
故答案为:52mol;
(5)由于镁不与氢氧化钠溶液反应,所以负极为铝,电解质为氢氧化钠溶液的负极反应为:![]() ,
,
故答案为:![]() ;
;
(6)由装置图可知,b极通入气体后产生气体,c极通入气体后产生水,故b极通入为甲醇,c极通入的是氧气,原电池负极发生氧化反应,正极反应还原反应,所以b为正极,c为负极,M连接的为电源正极,则M为阳极,Al在阳极放电;
故答案为:Al。

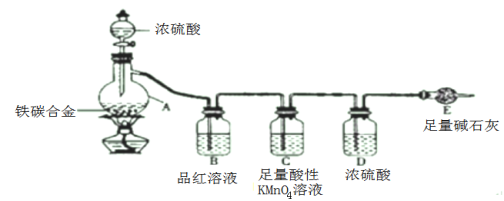
【题目】氨气与适量氯气混合反应可生成NH4Cl(岩脑砂的主要成分)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。
A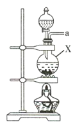 B
B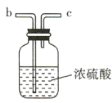
C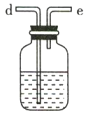 D
D
(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为 ________________ 。
(2)要得到干燥纯净的氯气,A、B、C装置中导管的连接顺序为a→ ________________ → ________________ → ________________ → ________________ 。
(3)利用D装置,将适量氨气与氯气充分混合,氨气应从__________ 通入,反应的化学方程式为 ___________;可能观察到的现象是________________。
(4)现取岩脑砂进行NH4Cl含量的测定。准确称取一定质量的岩脑砂,与足量的氧化铜混合,如图所示进行实验。已知:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O
3Cu+N2↑+2HCl↑+3H2O
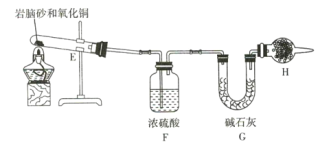
①为顺利完成有关物理量的测定,请完善下列表格。
测量时间点 | 反应前 | 反应后 |
测量内容 | ________________ | 当观察到 ________________ 现象时停止加热,冷却,称量H装置的总质量 |
②如果不用H装置,测出NH4Cl的含量将 _____ (填“偏高”“偏低”或“无影响”)。