题目内容
氮元素广泛存在于自然界中,对人类生命和生活具有重要意义。含氮元素的化合物在工业生产和国防建设中都有广泛的应用。
(1)氮元素原子核外有 个未成对电子,最外层有 种能量不同的电子。PH3分子的空间构型为 ,是 分子。(填极性或非极性)
(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是 (填编号)
a.NH3比PH3稳定性强
b.硝酸显强氧化性,磷酸不显强氧化性
c.氮气与氢气能直接化合,磷与氢气很难直接化合
d.氮气常温是气体,磷单质是固体
亚硝酸盐是食品添加剂中急性毒性较强的物质之一,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。
(3)亚硝酸钠溶液滴加到K2Cr2O7酸性溶液中,溶液由橙色变为绿色,反应如下,补上缺项物质并配平:
Cr2O72-+ NO2-+ → Cr3+ + NO3-+
(4)上题反应中每消耗0.6mol NO2-,转移电子数为 。
(5)氮氧化物(NO和NO2)污染环境。若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1 mol,则反应的离子方程式为 。
(1)3 2 三角锥形 极性
(2)a c
(3)Cr2O72-+ 3NO2-+ 8H+ →2Cr3+ + 3NO3-+ 4H2O
(4)1.2NA
(5)2NO2+CO32-→ NO2-+NO3-+CO2
解析试题分析:(1)氮元素的原子序数是7,其核外电子排布为1s22s22p3,原子核外有3个未成对电子,最外层有2种能量不同的电子。PH3分子中P原子含有1对孤对电子,价电子数是4,所以其空间构型为三角锥形,是极性分子。
(2)a.非金属性越强,氢化物的稳定性越强,因此NH3比PH3稳定性强可以说明二者非金属性相对强弱,a正确;b.硝酸显强氧化性,磷酸不显强氧化性与非金属性强弱无关系,b不正确;c.非金属性越强,越容易与氢气化合,因此氮气与氢气能直接化合,磷与氢气很难直接化合可以说明二者非金属性相对强弱,c正确;d.氮气常温是气体,磷单质是固体,非金属性强弱与状态无关系,d不正确,答案选ac。
(3)根据方程式可知Cr元素的化合价从+6价降低到+3价,得到3个电子。氮元素的化合价从+3价升高到+5价,失去2个电子,所以根据电子得失守恒可知配平后的方程式为Cr2O72-+ 3NO2-+ 8H+ →2Cr3+ + 3NO3-+ 4H2O。
(4)氮元素的化合价从+3价升高到+5价,失去2个电子,所以每消耗0.6mol NO2-,转移电子数为0.6×2×NA=1.2NA。
(5)9.2gNO2的物质的量是9.2g÷46g/mol=0.2mol,反应中转移0.1mol电子,所以在反应中NO2部分不还原为亚硝酸根,另外一部分转化为硝酸根,所以反应的离子方程式为2NO2+CO32-→ NO2-+NO3-+CO2。
考点:考查核外电子排布、非金属性强弱比较以及氧化还原反应的有关应用与计算

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案实验室可用NaNO2+NH4Cl =NaCl+N2↑+2H2O制备N2,下列说法正确的是
| A.NaNO2发生氧化反应 |
| B.NH4Cl中的氮元素被还原 |
| C.N2既是氧化产物,又是还原产物 |
| D.每生成1mol N2转移电子的物质的量为6mol |
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下: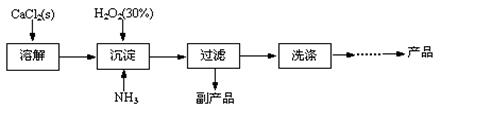
(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
① ;② 。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200mol·L—1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为 。
(4)根据表1数据计算产品中CaO2·8H2O的质量分数(写出计算过程):
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
表1. KMnO4标准溶液滴定数据
 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O

 Cu+____CuCl2+N2↑+____H2O。
Cu+____CuCl2+N2↑+____H2O。