��Ŀ����
��17�֣�H2O2��һ����ɫ������ԭ�Լ����ڻ�ѧ�о���Ӧ�ù㷺��
��1��ijС������ͬŨ��Fe3+�Ĵ��£�̽��H2O2Ũ�ȶ�H2O2�ֽⷴӦ���ʵ�Ӱ�졣��ѡ�Լ���������30% H2O2��0.1mol?L-1Fe2(SO4)3������ˮ����ƿ��˫������ˮ�ۡ����ܡ��������ܡ���Ͳ�����������ˮԡ�ۡ�ע����
��д����ʵ��H2O2�ֽⷴӦ����ʽ����������ת�Ƶķ������Ŀ��____________
�����ʵ�鷽�����ڲ�ͬH2O2Ũ���£��ⶨ ____________________________________��Ҫ������õ�������ֱ�����ַ�Ӧ���ʴ�С����
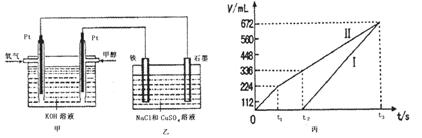
�����ʵ��װ�ã������ͼ��װ��ʾ��ͼ��
�ܲ����±���ʽ���ⶨʵ�������������ʵ�鷽�����г���ѡ�Լ���������¼�Ĵ��������������ⶨ�����ݣ���������ĸ��ʾ����
��2������ͼ21��a����21��b���е���Ϣ����ͼ21��c��װ�ã����ܵ�A��Bƿ���ѳ���NO2���壩����ʵ�顣�ɹ۲쵽Bƿ��������ɫ��Aƿ�е�_________������dz��������ԭ����______________________________________________________��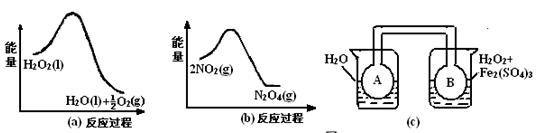
��1����
��������ͬ��������������ʱ��
��
�ܲⶨ��Ӧʱ��
��2�����Ϊ��������ֽ��Ƿ��ȷ�Ӧ��2NO2(g) H2O2�����(mL) 0.1mol?L-1Fe2(SO4)3�������mL�� ��������ˮ�������mL�� ����O2�����(mL) ��Ӧʱ�䣨min�� ʵ��1 b a c d ʵ��2 c a b d 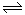 N2O4(g)Ҳ�Ƿ��ȷ�Ӧ������Bƿ�¶ȸ���Aƿ���¶����ߣ�ƽ�������ƶ�����������Ũ��������ɫ���
N2O4(g)Ҳ�Ƿ��ȷ�Ӧ������Bƿ�¶ȸ���Aƿ���¶����ߣ�ƽ�������ƶ�����������Ũ��������ɫ���
���������������1���ٹ��������������������������·ֽ�����ˮ�������������������������������ԭ������ѧ����ʽ������ת�Ʒ������ĿΪ
�ڷ�Ӧ�����ǵ�λʱ��������Ũ�ȵĸı��������Բⶨ��ͬŨ�ȵĹ�������Էֽ����ʵ�Ӱ�죬��ⶨ��ͬʱ���ڣ���������������Ķ��٣���������ͬ�������������ʱ��Ķ��٣�
��������ˮ���������ռ�һ�������O2����Ҫˮ�ۡ���Ͳ�������ܣ���Ͳ��ʢ��ˮ������ˮ���У�װ����ͼ
��
��2����ͼa��֪��������ķֽⷴӦ�Ƿ��ȷ�Ӧ����ͼb��֪��������ת��Ϊ�����������ķ�ӦҲ�Ƿ��ȷ�Ӧ������װ��c�У��Ҳ��ձ�Bƿ�¶ȸ�������ձ�Aƿ�����¶����ߣ�ʹƽ��2NO2(g) H2O2�����(mL) 0.1mol?L-1Fe2(SO4)3�������mL�� ��������ˮ�������mL�� ����O2�����(mL) ��Ӧʱ�䣨min�� ʵ��1 b a c d ʵ��2 c a b d 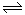 N2O4(g)������У���������Ũ������Bƿ����ɫ��Aƿ����ɫ�
N2O4(g)������У���������Ũ������Bƿ����ɫ��Aƿ����ɫ�
���㣺�����ʵ��ķ�������ƣ�������ԭ��Ӧ�ķ���������ת�Ƶı�ʾ��ƽ����ƶ����ж�

 ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�����������NF3����һ�����͵��Ӳ��ϣ����ڳ�ʪ�Ŀ�������ˮ�����ܷ���������ԭ��Ӧ���䷴Ӧ�IJ����У� HF�� NO �� HNO3��������˵��������ǣ�( )
| A����Ӧ�����У��������뱻��ԭ��Ԫ�ص����ʵ���֮��Ϊ1 ��2 |
| B��NF3��һ����ɫ���������壬���NF3�ڿ�����й©ʱ���ױ���� |
| C��һ��NF3й©��������NaOH��Һ���ܵķ������ٿ�����Ⱦ |
| D������Ӧ������1.0mol NO��ת�Ƶĵ�����ĿΪ6.02��1023 |
��12 �֣���ԭ������������ĵ���ƽ�ⳣ�������
| ���� | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
| ����ƽ�ⳣ�� ��25�棩 | K=1.8��10��4 | K=5.1��10��4 | K1=9.1��10��8 K2=1.1��10��12 | K1=1.23��10��2 K2=6.6��10��8 | K1=5.4��10��2 K2=5.4��10��5 |
��2���ϱ���5������бȽϣ������������ǣ�_______________��HCOO����S2����HSO3�� 3�������У����ѽ��H+���� ��
��3����Ũ�Ⱦ�Ϊ0.1mol/L��HCOOH��H2C2O4�����Һ�У�����0.1mol/L��NaOH��Һ����OH���Ⱥ����ĵ��ἰ��ʽ��������ǣ�_______________________��
��4����֪HNO2����ǿ�����ԣ�����ԭ�ԡ���HNO2��Һ�μӵ�H2S��Һ�У�ͬʱ�г�������ɫ�������ɣ�������������������Ϊ����ɫ����д������֮��Ļ�ѧ��Ӧ����ʽ��_____________________________________________��
��5���������ӷ���ʽ��д��ȷ����
A�� HNO2 + HS�� ="=" NO2��+ H2S��
B�� 2HCOOH+SO32�� ="=" 2HCOO��+H2O+SO2��
C�� H2SO3+2HCOO�� ="=" 2HCOOH+SO32��
D�� H2SO3+ SO3 2�� ="=" 2HSO3��
 ��Fe(NO3)3��NO����2H2O
��Fe(NO3)3��NO����2H2O
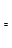 CH3OH(g)��
CH3OH(g)��