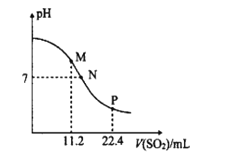
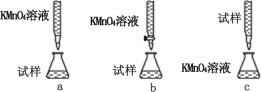
题目内容
【题目】下列装置能达到实验目的的是( )
A.探究AgCl和AgI之间的转化 
B.比较Cl2、Br2、I2的氧化性强弱 ![]()
C.制备Fe(OH)2 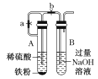
D.用已知浓度的氢氧化钠溶液测定盐酸浓度的实验 
【答案】C
【解析】
A. 硝酸银过量,生成氯化银沉淀后,Ag+剩余,继续生成碘化银沉淀,无法探究AgCl和AgI之间的转化,故A错误;
B. 氯气依次通过两棉球,通过现象可以证明氯气的氧化性强于Br2和I2,但无法比较Br2、I2的氧化性,故B错误;
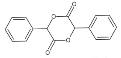
C. 根据装置特点分析,先打开a和b,A中生成的氢气排出装置的空气,防止Fe(OH)2被氧化,关闭a时,生成的氢气将A中反应产物硫酸亚铁通过导管压入B中的氢氧化钠溶液中,反应得到Fe(OH)2,故C正确;
D. 氢氧化钠溶液应该装在碱式滴定管内(下部为橡胶管),故D错误;
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案【题目】2硝基1,3苯二酚由间苯二酚先磺化,再硝化,后去磺酸基生成。原理如下:

部分物质的相关性质如下:
名称 | 相对分子质量 | 性状 | 熔点/℃ | 水溶性(常温) |
间苯二酚 | 110 | 白色针状晶体 | 110.7 | 易溶 |
2硝基1,3苯二酚 | 155 | 桔红色针状晶体 | 87.8 | 难溶 |
制备过程如下:
第一步:磺化。称取71.5g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内15min(如图1)。
第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌15min。
第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶B中,然后用图2所示装置进行水蒸气蒸馏(水蒸气蒸馏可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的)。

请回答下列问题:
(1)磺化步骤中控制温度最合适的范围为(填字母)__。
a.30℃~60℃ b.60℃~65℃ c.65℃~70℃ d.70℃~100℃
(2)图2中的冷凝管是否可以换为图1所用冷凝管___(填“是”或“否”)。
(3)硝化步骤中制取“混酸”的具体操作是__。
(4)图2中,烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止__;冷凝管C中可能看到的现象是__,反应一段时间后,停止蒸馏,此时的操作是__(填有关旋塞和酒精灯的操作)。
(5)水蒸气蒸馏是分离和提纯有机物的方法之一,被提纯物质必须具备的条件正确的是__。
a.不溶或难溶于水,便于最后分离
b.在沸腾下与水不发生化学反应
c.难挥发性
d.易溶于水
(6)本实验最终获得12.0g桔红色晶体,则2硝基1,3苯二酚的产率约为__。(保留3位有效数字)
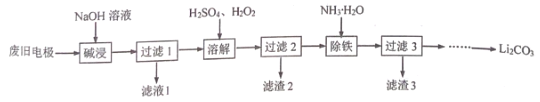
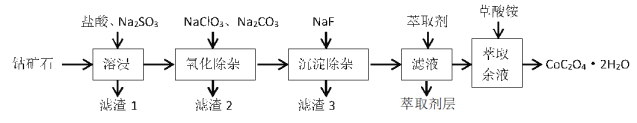
【题目】利用一种钴矿石(主要成分为 Co2O3,含少量 SiO2及铁、铝、锰、镁、钙等金属元素的氧化物)制取CoC2O42H2O 晶体的工艺流程如下:
已知部分阳离子以氢氧化物形式沉淀时溶液 pH 如表
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的 pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)溶浸过程中 Co2O3 发生反应的离子方程式为_____。
(2)氧化除杂过程中加入 Na2CO3 的主要目的是__________,若不加入 NaClO3,其后果是_____。
(3)滤渣 3 的成分是____________,滤液中加入萃取剂的目的是除去_________元素(填元素符号)。
(4)萃取余液中加入草酸铵后,获取 CoC2O4·2H2O 晶体的操作是___________。
(5)含钴化合物 LiCoO2是废旧锂电池的正极材料,可与双氧水、稀 H2SO4 混合加热得到 CoSO4回收利用,该过程发生反应的化学方程式是____________。
(6)已知某温度下 Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10,当加入过量NaF溶液后,所得滤液中c(Ca2+)/c(Mg2+) =___________。
【题目】下表是三种难溶金属硫化物的溶度积常数(25℃):
化学式 | FeS | CuS | MnS |
溶度积 | 6.3×10-18 mol2·L-2 | 1.3×10-36 mol2·L-2 | 2.5×10-13 mol2·L-2 |
下列有关说法中正确的是
A.25℃时,CuS 的溶解度大于 MnS 的溶解度
B.除去某溶液中的 Cu2+,可以选用 FeS 作沉淀剂
C.因为 H2SO4 是强酸,所以反应 CuSO4+H2S = CuS↓+H2SO4不能发生
D.25℃时,饱和 CuS 溶液中,Cu2+的浓度为 1.3×10-36 mol·L-1