题目内容
【题目】以经预处理的废旧磷酸亚铁锂电极(主要成分为LiFePO4、 Al、C)为原料,生产Li2CO3 的部分工艺流程如下:
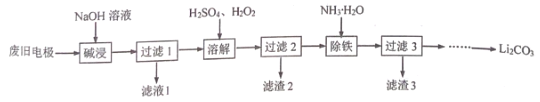
已知:LiFePO4难溶于水和碱性溶液,可溶于酸性溶液。Li2CO3溶于稀酸,微溶于水。下列说法不正确的是
A.滤渣2的主要成分为C
B.溶解时发生反应的离子反应方程式:2LiFePO4+2H++H2O2=2Li++2Fe3++ 2![]() + 2H2O
+ 2H2O
C.向过滤3的滤液中加入饱和Na2CO3溶液即可生成Li2CO3沉淀
D.已知将Li2CO3、FePO4x H2O、H2C2O4 混合反应可重新获得LiFePO4,理论上完全反应消耗的n(Li2CO3):n(FePO4x H2O):n(H2C2O4)=1:2:1
【答案】B
【解析】
根据流程:废旧磷酸亚铁锂电极(主要成分为LiFePO4、Al、C)用NaOH溶液碱浸:2Al+2OH-+2H2O═2AlO2-+3H2↑,过滤,滤渣为LiFePO4、C,加入稀硫酸、过氧化氢溶 2LiFePO4+4H2SO4+H2O2═Li2SO4+Fe2(SO4)3+2H3PO4+2H2O,C不溶,过滤除去,滤渣2为C;向滤液中加入氨水将Fe3+沉淀为Fe(OH)3,过滤,滤渣3为Fe(OH)3,向过滤3的滤液中加入饱和Na2CO3溶液可生成Li2CO3沉淀,据此分析作答。
A.根据上述分析,滤渣2的主要成分为C,故A正确;
B.溶解时的反应为LiFePO4与稀硫酸、过氧化氢反应,化学方程式为:2LiFePO4+4H2SO4+H2O2═Li2SO4+Fe2(SO4)3+2H3PO4+2H2O,离子反应为:2LiFePO4+8H++H2O2=2Li++2Fe3++2H3PO4+ 2H2O,故B错误;
C.根据分析,向过滤3的滤液中加入饱和Na2CO3溶液即可生成Li2CO3沉淀,故C正确;
D.已知将Li2CO3、FePO4x H2O、H2C2O4 混合反应可重新获得LiFePO4,反应为:Li2CO3+2FePO4xH2O+H2C2O4=2LiFePO4+3CO2↑+(2x+1)H2O,理论上完全反应消耗的n(Li2CO3):n(FePO4x H2O):n(H2C2O4)=1:2:1,故D正确;
答案选B。

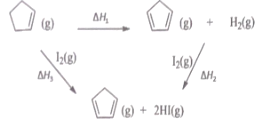
【题目】环戊二烯之(![]() ) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
共价键 | 键能/ |
H-H | 436 |
H-I | 299 |
I-I | 151 |
A.△H1+△H2+△H3=0
B.△H1<△H3
C.![]() (g)转化为
(g)转化为![]() (g)的过程中,有C-H的断裂和形成
(g)的过程中,有C-H的断裂和形成
D.在相同条件下,生成 2molHCl(g) 的△H2′<△H2