题目内容
【题目】工业排放的烟气中的SO2是大气的一次污染物之一,同时也是雾篮天气的重要前体物。工业上常用氨水吸二氧化硫气体。常温时,向10mL0.1molL-l的氨水中通入SO2,SO2体积(标准状况)与溶液pH的关系如图所示(忽略溶液体积变化)。
已知:25℃时,NH3H2O的Kb=l.7×l0-5,H2SO3的Ka1=l.3×10-2,Ka2=6.2×l0-8。
回答下列问题:
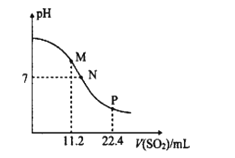
(1)M点溶液中阴离子浓度由大到小的顺序为__,![]() __(填>、=或<)2。
__(填>、=或<)2。
(2)N点溶液中的溶质为__(填化学式),c(NH4+):c(HSO3-)=__。
(3)水的电离程度M点__P点(填“大于”、“小于”或“等于”)。
(4)反应NH3H2O+H2SO3![]() NH4++HSO3-+H2O的平衡常数K=__。
NH4++HSO3-+H2O的平衡常数K=__。
【答案】c(OH-)>c(HSO3-)>c(SO32-) > NH4HSO3和NH3H2O 2.24 < 2.21×107
【解析】
(1)M点n(SO2)=![]() mol=5×l0-4mol/L,n(NH3H2O)=0.1mol/L×0.01L=l0-3mol/L,则混合溶液中溶质为等物质的量浓度的NH4HSO3和NH3H2O,溶液pH>7,溶液呈碱性,c(OH-)>c(H+),说明NH3H2O电离程度大于HSO3-电离程度,HSO3-电离程度较小;溶液呈碱性,c(OH-)>c(H+),溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),则c(NH4+)>2c(SO32-)+c(HSO3-);
mol=5×l0-4mol/L,n(NH3H2O)=0.1mol/L×0.01L=l0-3mol/L,则混合溶液中溶质为等物质的量浓度的NH4HSO3和NH3H2O,溶液pH>7,溶液呈碱性,c(OH-)>c(H+),说明NH3H2O电离程度大于HSO3-电离程度,HSO3-电离程度较小;溶液呈碱性,c(OH-)>c(H+),溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),则c(NH4+)>2c(SO32-)+c(HSO3-);
(2)M点溶质为等物质的量浓度的NH4HSO3和NH3H2O,P点n(SO2)=![]() mol=l0-3mol/L=n(NH3H2O),溶质为NH4HSO3,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(NH4+)=2c(SO32-)+c(HSO3-),
mol=l0-3mol/L=n(NH3H2O),溶质为NH4HSO3,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(NH4+)=2c(SO32-)+c(HSO3-),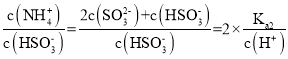 +1;
+1;
(3)M点溶质为等物质的量浓度的NH4HSO3和NH3H2O,抑制水电离,P点溶质为NH4HSO3,抑制水电离;
(4)反应NH3H2O+H2SO3NH4++HSO3-+H2O的平衡常数K= 。
。
(1)M点n(SO2)=![]() mol=5×l0-4mol/L,n(NH3H2O)=0.1mol/L×0.01L=l0-3mol/L,则混合溶液中溶质为等物质的量浓度的NH4HSO3和NH3H2O,溶液pH>7,溶液呈碱性,c(OH-)>c(H+),说明NH3H2O电离程度大于HSO3-电离程度,HSO3-电离程度较小;溶液呈碱性,c(OH-)>c(H+),溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),则c(NH4+)>2c(SO32-)+c(HSO3-),所以
mol=5×l0-4mol/L,n(NH3H2O)=0.1mol/L×0.01L=l0-3mol/L,则混合溶液中溶质为等物质的量浓度的NH4HSO3和NH3H2O,溶液pH>7,溶液呈碱性,c(OH-)>c(H+),说明NH3H2O电离程度大于HSO3-电离程度,HSO3-电离程度较小;溶液呈碱性,c(OH-)>c(H+),溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),则c(NH4+)>2c(SO32-)+c(HSO3-),所以 >2;
>2;
(2)M点溶质为等物质的量浓度的NH4HSO3和NH3H2O,P点n(SO2)=![]() mol=l0-3mol/L=n(NH3H2O),溶质为NH4HSO3,N点介于M、P点之间,则N点溶质为NH4HSO3和NH3H2O;溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(NH4+)=2c(SO32-)+c(HSO3-),
mol=l0-3mol/L=n(NH3H2O),溶质为NH4HSO3,N点介于M、P点之间,则N点溶质为NH4HSO3和NH3H2O;溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(NH4+)=2c(SO32-)+c(HSO3-),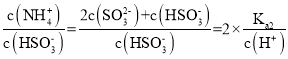 +1=2×
+1=2×![]() =2.24;
=2.24;
(3)M点溶质为等物质的量浓度的NH4HSO3和NH3H2O,抑制水电离,P点溶质为NH4HSO3,抑制水电离,抑制水电离程度:M>P,所以水电离程度:M<P;
(4)反应NH3H2O+H2SO3NH4++HSO3-+H2O的平衡常数K= =
=![]() =2.21×107。
=2.21×107。

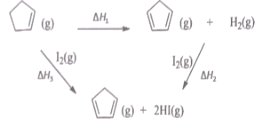
【题目】环戊二烯之(![]() ) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
共价键 | 键能/ |
H-H | 436 |
H-I | 299 |
I-I | 151 |
A.△H1+△H2+△H3=0
B.△H1<△H3
C.![]() (g)转化为
(g)转化为![]() (g)的过程中,有C-H的断裂和形成
(g)的过程中,有C-H的断裂和形成
D.在相同条件下,生成 2molHCl(g) 的△H2′<△H2