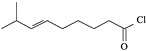
题目内容
【题目】某实验小组为了分析补血剂 FeSO4·7H2O 中铁元素的质量分数,用 KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4- +8H+= 5Fe3++Mn2++4H2O。
(1)实验前,首先要精确配制一定物质的量浓度的 KMnO4 溶液 250 mL,配制时需要用的仪器除天平、药匙、玻璃棒、烧杯、胶头滴管外,还需____________。
(2)滴定前是否要滴加指示剂?_____(填“是”或“否”),理由是_____。
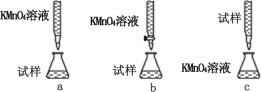
(3)某同学设计的下列滴定方式中,最合理的是_____(填序号)
(4)该实验小组称取 12.0 g 补血剂在容量瓶中配成 100 mL 溶液,量取 25.00 mL 试样溶液, 用 0.100 mol·L-1 KMnO4标准溶液滴定。 达到滴定终点时, 消耗标准溶液20.00 mL,则所测补血剂中铁元素的质量分数是_____(精确至 0.01%)。
(5)若该小组配制溶液和滴定操作时引起的误差忽略,最终所测补血剂中铁元素含量 仍偏小,其可能原因是_____。
【答案】250 mL 容量瓶 否 KMnO4 溶液为紫红色,自身可作指示剂 b 18.67% Fe2+容易被空气中的氧气氧化成 Fe3+,消耗的 KMnO4 溶液体积偏小
【解析】
(1)配制一定物质的量浓度的溶液所需要的仪器有:250mL容量瓶、天平、玻棒、烧杯、量筒、药匙、胶头滴管;
(2)KMnO4 溶液为紫红色,自身可作指示剂,故不需要加指示剂;
(3)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察,应将高锰酸钾滴到待测液中;
(4)根据5Fe2++MnO4- +8H+= 5Fe3++Mn2++4H2O,5Fe2+~MnO4-,则n(Fe)=n(Fe2+)= 5n(MnO4-)=5×0.100 mol·L-1×0.0200 L=0.01mol,m(Fe)=nM=0.01mol×4×56g/mol=2.24g,ω=![]() ×100% =18.67%;
×100% =18.67%;
(5) 最终所测补血剂中铁元素含量仍偏小,可能是由于Fe2+容易被空气中的氧气氧化成 Fe3+,消耗的 KMnO4 溶液体积偏小。

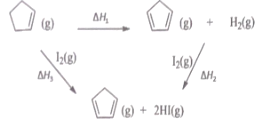
【题目】环戊二烯之(![]() ) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
共价键 | 键能/ |
H-H | 436 |
H-I | 299 |
I-I | 151 |
A.△H1+△H2+△H3=0
B.△H1<△H3
C.![]() (g)转化为
(g)转化为![]() (g)的过程中,有C-H的断裂和形成
(g)的过程中,有C-H的断裂和形成
D.在相同条件下,生成 2molHCl(g) 的△H2′<△H2