题目内容
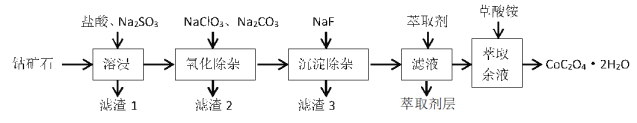
【题目】利用一种钴矿石(主要成分为 Co2O3,含少量 SiO2及铁、铝、锰、镁、钙等金属元素的氧化物)制取CoC2O42H2O 晶体的工艺流程如下:
已知部分阳离子以氢氧化物形式沉淀时溶液 pH 如表
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的 pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)溶浸过程中 Co2O3 发生反应的离子方程式为_____。
(2)氧化除杂过程中加入 Na2CO3 的主要目的是__________,若不加入 NaClO3,其后果是_____。
(3)滤渣 3 的成分是____________,滤液中加入萃取剂的目的是除去_________元素(填元素符号)。
(4)萃取余液中加入草酸铵后,获取 CoC2O4·2H2O 晶体的操作是___________。
(5)含钴化合物 LiCoO2是废旧锂电池的正极材料,可与双氧水、稀 H2SO4 混合加热得到 CoSO4回收利用,该过程发生反应的化学方程式是____________。
(6)已知某温度下 Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10,当加入过量NaF溶液后,所得滤液中c(Ca2+)/c(Mg2+) =___________。
【答案】Co2O3+SO32-+4H+=2Co2++SO42-+2H2O 加入Na2CO3调节pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀 亚铁离子不能氧化成铁离子而除去 CaF2、MgF2 Mn 蒸发浓缩、冷却结晶、过滤、洗涤、干燥 2LiCoO2+H2O2+3H2SO4![]() 2CosO4+Li2SO4+4H2O+O2↑ 1.43
2CosO4+Li2SO4+4H2O+O2↑ 1.43
【解析】
含钴废料中加入盐酸和亚硫酸钠,除去不溶物质滤河渣1,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2,加入NaClO3,可FeCl2氧化得到FeCl3,然后加入Na2CO3调pH至5.2,可得到滤渣2,主要成分为Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,除去钙镁离子,然后过滤,滤渣3为CaF2、MgF2,得到的滤液中加入萃取剂,除去锰元素,萃取后溶液加入草酸铵,得到草酸钴溶液,由萃后余液通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到CoC2O4·2H2O。
(1)溶浸过程中 Co2O3 被还原生成Co2+,发生反应的离子方程式为Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;故答案为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)氧化除杂过程中加入 Na2CO3 调节pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,若不加入 NaClO3,其后果是亚铁离子不能氧化成铁离子而除去;故答案为:加入Na2CO3调节pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀;亚铁离子不能氧化成铁离子而除去。
(3)滤渣3为CaF2、MgF2,滤液中加入萃取剂的目的是除去Mn元素(填元素符号)。故答案为:CaF2、MgF2;Mn;
(4)由萃后余液通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到CoC2O4·2H2O 晶体。故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)含钴化合物 LiCoO2是废旧锂电池的正极材料,可与双氧水、稀 H2SO4 混合加热得到 CoSO4回收利用,同时生成硫酸锂、水和氧气,发生反应的化学方程式是2LiCoO2+H2O2+3H2SO4![]() 2CosO4+Li2SO4+4H2O+O2↑。故答案为:2LiCoO2+H2O2+3H2SO4
2CosO4+Li2SO4+4H2O+O2↑。故答案为:2LiCoO2+H2O2+3H2SO4![]() 2CosO4+Li2SO4+4H2O+O2↑;
2CosO4+Li2SO4+4H2O+O2↑;
(6)当加入过量NaF溶液后,溶液中存在平衡:Mg2++CaF2![]() MgF2+Ca2+,
MgF2+Ca2+, =1.43。故答案为:1.43。
=1.43。故答案为:1.43。

【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:
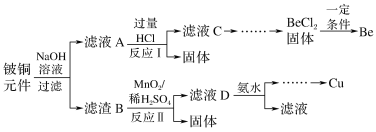
已知:Ⅰ.铍、铝元素的化学性质相似,单质铍与氢氧化钠溶液反应生成可溶于水的Na2BeO2
Ⅱ.常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
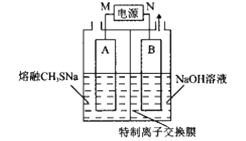
(1)滤液A的主要成分除NaOH外,还有__(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:__。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为__(填字母)。
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中得到BeCl2固体的操作是__。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:__。
②若用浓HNO3溶解金属硫化物,缺点是__(任写一条)。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是__(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于__。
(5)电解NaCl-BeCl2混合熔盐可制备金属铍,如图是电解装置图。
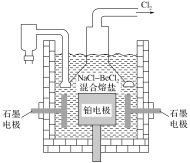
①石墨电极上的电极反应式为__。
②电解得到的Be蒸气中约含1%的Na蒸气除去Be中少量Na的方法为__。
已知部分物质的熔、沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(______)4mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(______)3mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
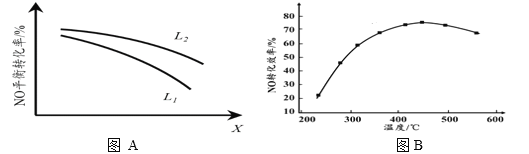
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;