题目内容
【题目】已知马尔氏盐晶体[(NH4)2Fe(SO4)2·6H2O]易溶于水,不溶于乙醇,受热易分解,是分析化学中的重要试剂。回答下列问题:
(1)马尔氏盐晶体的制备:
甲组同学利用新生成的硫酸亚铁溶液与硫酸铵溶液反应制备马尔氏盐晶体(已知所使用的铁屑中含有少量的Fe2O3和FeS杂质),装置如图所示;

①为了使A中所制得的FeSO4中不含Fe3+,应使______________________过量(填化学式)。
②实验前期,需要用生成的H2将装置中的空气排尽,其原因是______________________,装置B中的试剂为____________(填写试剂名称)。
③装置A中反应一段时间后,若不拆卸装置,如何使装置A中生成的FeSO4进入装置C中,叙述操作过程____________________________________________。
(2)验证马尔氏盐晶体分解的气态产物成分:
提出假设:马尔氏盐晶体分解可能生成H2O、NH3、SO3、___________等气态化合物。
实验验证:实验小组取一定量马尔氏盐晶体隔绝空气加强热分解,利用下列裝置检验气态产物的成分(防倒吸装置已略去),试完成下表:
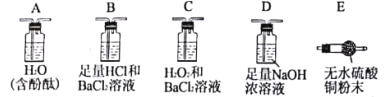
操作步骤 | 实验现象 | 结论 |
①按___→___→____顺序连接装置(填字母)。 | ②______________________ ______________________。 | 证明气体产物中含有H2O和NH3。 |
③按B→C→D顺序连接装置,其中装置B的作用是______________________。 | B中无明显现象,C中有白色沉淀生成。 | ④_____________________ ______________________。 |
【答案】Fe 防止空气中的氧气氧化Fe2+ NaOH溶液 关闭止水夹1、3、4,打开止水夹2 SO2 E D A E中无水硫酸铜由白色变为蓝色 A中溶液变为红色 吸收NH3,检验是否存在SO3 气体产物中无SO3 有SO2
【解析】
本题主要从铁极其化合物、硫及其化合物性质的角度出发,考查常见实验操作和实验现象的理解。
(1)①Fe过量可发生反应2Fe3++Fe=3Fe2+,防止Fe3+剩余;
②Fe2+易被氧气氧化,需排除装置中残留的空气;A中含有杂质FeS,生成H2中混有H2S,故装置B中NaOH溶液可除去H2S气体;
③关闭止水夹1、3、4,打开止水夹2后,产生H2使A中压强增大,将溶液压入C瓶中反应。
故本题答案为:Fe;防止空气中的氧气氧化Fe2+;NaOH溶液;关闭止水夹1、3、4,打开止水夹2。
(2)因为三氧化硫可以分解为二氧化硫和氧气,分解的气态产物可能还有SO2和氧气等等;
①根据实验结论(气体产物中含有H2O和NH3),应先通过E证明含有H2O,再通过D除去SO3和SO2,然后通入A,溶液变红,证明含有NH3;
②对应的实验现象为E中无水硫酸铜由白色变为蓝色,A中溶液变为红色;
③按B→C→D顺序连接装置,由于氨气易溶于酸中、三氧化硫易和水化合生成硫酸,硫酸可以与氯化钡反应生成硫酸钡沉淀,故装置B的作用是:吸收NH3,检验是否存在SO3;
④B中无明显现象,证明不含有SO3,C中有白色沉淀生成,证明气体产物中有二氧化硫,H2O2将SO2氧化为SO42-,然后与氯化钡反应生成BaSO4沉淀。
故本题答案为:E、D、A;E中无水硫酸铜由白色变为蓝色,A中溶液变为红色;吸收NH3,检验是否存在SO3;气体产物中无SO3,有SO2

 应用题作业本系列答案
应用题作业本系列答案【题目】工业上消除氮氧化物的污染,可用如下反应:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法不正确的是
A. 10 min内,T1时v(CH4)T2时小 B. 温度:T1<T2
C. ΔH:a < 0 D. 平衡常数:K(T1)<K(T2)