题目内容
【题目】常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol/L NaOH溶液,整个过程中pH的变化如图所示。下列有关叙述中正确的是
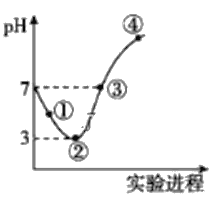
A. 曲线③④段有离子反应:HClO+OH-=ClO-+H2O
B. 可依据②处数据计算所溶解的n(Cl2)
C. ③处表示氯水与氢氧化钠溶液恰好反应完全
D. ①处c(H+)约为②处c(H+)的两倍
【答案】A
【解析】
整个过程发生的反应为Cl2+H2O![]() HCl+HClO、HCl+NaOH=NaCl+H2O、HClO+NaOH=NaClO+H2O,①点所示溶液中发生反应:Cl2+H2O
HCl+HClO、HCl+NaOH=NaCl+H2O、HClO+NaOH=NaClO+H2O,①点所示溶液中发生反应:Cl2+H2O![]() H++Cl-+HClO,②点所示溶液中发生反应:Cl2+H2O
H++Cl-+HClO,②点所示溶液中发生反应:Cl2+H2O![]() H++Cl-+HClO,HClO为弱电解质,部分电离,溶液中存在的粒子有:H+、Cl-、ClO-、OH-,H2O、HClO、Cl2,③点所示溶液中发生反应:HCl+NaOH═NaCl+H2O、HClO+NaOH=NaClO+H2O,溶液呈中性,则c(H+)=c(OH-),HClO未被完全中和;④点溶液呈碱性,反应仅有HClO+NaOH=NaClO+H2O,根据溶液的酸碱性结合盐类水解等知识分析解答。
H++Cl-+HClO,HClO为弱电解质,部分电离,溶液中存在的粒子有:H+、Cl-、ClO-、OH-,H2O、HClO、Cl2,③点所示溶液中发生反应:HCl+NaOH═NaCl+H2O、HClO+NaOH=NaClO+H2O,溶液呈中性,则c(H+)=c(OH-),HClO未被完全中和;④点溶液呈碱性,反应仅有HClO+NaOH=NaClO+H2O,根据溶液的酸碱性结合盐类水解等知识分析解答。
A. ③点所示溶液中发生反应:HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,溶液呈中性,则c(H+)=c(OH-),HClO未被完全中和;④点溶液呈碱性,反应仅有HClO+NaOH=NaClO+H2O,所以曲线③④段发生离子反应:HClO+OH-=H2O+ClO-,A正确;
B.②点所示溶液中发生反应:Cl2+H2O![]() H++Cl-+HClO,HClO为弱电解质,部分电离,无法根据pH计算参加反应的氯气,B错误;
H++Cl-+HClO,HClO为弱电解质,部分电离,无法根据pH计算参加反应的氯气,B错误;
C.③点所示溶液中发生反应:HCl+NaOH=NaCl+H2O、HClO+NaOH=NaClO+H2O,溶液呈中性,c(H+)=c(OH-),根据电荷守恒得c(Na+)+c(H+)=c(ClO-)+c(Cl-)+c(OH-),若是恰好反应,溶液为NaCl、NaClO混合物,此时溶液应该显碱性,而此时溶液为中性,显然NaOH不足量,C错误;
D.①处至②处是氯气的溶解平衡:Cl2+H2O![]() H++Cl-+HClO向右进行的过程,溶液的酸性逐渐增强,氢离子浓度逐渐增大,但不是2倍的关系,D错误;
H++Cl-+HClO向右进行的过程,溶液的酸性逐渐增强,氢离子浓度逐渐增大,但不是2倍的关系,D错误;
故合理选项是A。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“>”、“<” 、“=”)。
②温度为500℃时,该反应10 min时达到平衡。用H2表示该反应的反应速率v(H2)=______________;该温度下,反应I的平衡常数K=______________L2/mol2
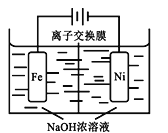
(4)由CO2制备甲醇还需要氢气。工业上用电解法制取Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
【题目】已知马尔氏盐晶体[(NH4)2Fe(SO4)2·6H2O]易溶于水,不溶于乙醇,受热易分解,是分析化学中的重要试剂。回答下列问题:
(1)马尔氏盐晶体的制备:
甲组同学利用新生成的硫酸亚铁溶液与硫酸铵溶液反应制备马尔氏盐晶体(已知所使用的铁屑中含有少量的Fe2O3和FeS杂质),装置如图所示;

①为了使A中所制得的FeSO4中不含Fe3+,应使______________________过量(填化学式)。
②实验前期,需要用生成的H2将装置中的空气排尽,其原因是______________________,装置B中的试剂为____________(填写试剂名称)。
③装置A中反应一段时间后,若不拆卸装置,如何使装置A中生成的FeSO4进入装置C中,叙述操作过程____________________________________________。
(2)验证马尔氏盐晶体分解的气态产物成分:
提出假设:马尔氏盐晶体分解可能生成H2O、NH3、SO3、___________等气态化合物。
实验验证:实验小组取一定量马尔氏盐晶体隔绝空气加强热分解,利用下列裝置检验气态产物的成分(防倒吸装置已略去),试完成下表:
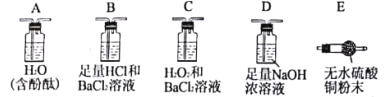
操作步骤 | 实验现象 | 结论 |
①按___→___→____顺序连接装置(填字母)。 | ②______________________ ______________________。 | 证明气体产物中含有H2O和NH3。 |
③按B→C→D顺序连接装置,其中装置B的作用是______________________。 | B中无明显现象,C中有白色沉淀生成。 | ④_____________________ ______________________。 |



