题目内容
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。

(1)在恒温,容积为1 L容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
①写出能表示硫的燃烧热的热化学方程式: _____________________________
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为___________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年单位GDP二氧化碳排放比2005年下降40%~50% 。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________

②能说明上述反应达到平衡状态的是______(填编号)
A、反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B、混合气体的密度不随时间的变化而变化
C、CO2的体积分数在混合气体中保持不变
D、单位时间内消耗3 mol H2,同时消耗1 mol H2O
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度B.缩小容器体积C.再充入CO2气体D.使用合适的催化剂
【答案】S(s)+O2(g)![]() SO2(g) ΔH=-297 kJ·mol-1 -78.64 20% 吸收 19.66 0.125 16/3 CD B
SO2(g) ΔH=-297 kJ·mol-1 -78.64 20% 吸收 19.66 0.125 16/3 CD B
【解析】
(1)①燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量;
②焓变与化学计量数有关;
③当充入1mol SO3,0.5mol O2时,相当于充入1mol SO2和1mol O2,和原平衡等效,据此分析;
(2)①根据速率公式计算速率;用三行式分析平衡时浓度,根据平衡常数表达式计算平衡常数;
②根据平衡状态判断方法判断是否达到平衡;
③根据平衡移动方向,分析改变的条件。
(1)①S燃烧生成SO2,所以对应的焓变为ΔH1,则表示硫的燃烧热的热化学方程式为S(s)+O2(g)![]() SO2(g) ΔH=-297 kJ·mol-1;
SO2(g) ΔH=-297 kJ·mol-1;
故答案为:S(s)+O2(g)![]() SO2(g) ΔH=-297 kJ·mol-1;
SO2(g) ΔH=-297 kJ·mol-1;
②根据反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1,2molSO2完全转化,放热196.6kJ,从图可知有0.8molSO2发生转化,则ΔH2=
2SO3(g) ΔH=-196.6 kJ·mol-1,2molSO2完全转化,放热196.6kJ,从图可知有0.8molSO2发生转化,则ΔH2=![]() ×0.8mol=-78.64kJ/mol;
×0.8mol=-78.64kJ/mol;
故答案为:-78.64;
③当充入1mol SO3,0.5mol O2时,相当于充入1mol SO2和1mol O2,和原平衡等效,所以SO3的转化率为(1-![]() )×100%=20%,此时反应要吸收热量,其热量为
)×100%=20%,此时反应要吸收热量,其热量为![]() -78.64 kJ=19.66kJ;
-78.64 kJ=19.66kJ;
故答案为:20%;吸收;19.66;
(2)①v(H2)=3v(CO2)=3![]() =0.125 mol·L-1·min-1;
=0.125 mol·L-1·min-1;
根据图2信息可以知道:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
初始浓度(mol/L): 1 3 0 0
变化浓度(mol/L):0.75 2.25 0.75 0.75
平衡浓度(mol/L):0.25 0.75 0.75 0.75
平衡常数为K=![]() =
=![]() =16/3;
=16/3;
故答案为:0.125;16/3;
②A、由图可知反应中CO2与CH3OH的物质的量浓度之比为1:1时,并未达到平衡状态,故A不选;
B、因气体的质量不变,容器的体积不变,则无论是否达到平衡状态,都存在混合气体的密度不随时间的变化而变化,不能判断是否达到平衡状态,故B不选;
C、CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故C选;
D、单位时间内消耗3 mol H2,同时消耗1 mol H2O,用不同物质表示的反应速率之比等于化学计量数之比,说明v(正)=v(逆),说明达到平衡状态,故D选;
综合以上分析,答案选CD。
③为了加快化学反应速率且使体系中气体的物质的量减少,说明要求平衡正向移动,
A.升高温度,平衡逆向移动,故A错误;
B.缩小容器体积,平衡正向移动,故B正确;
C.再充入CO2气体, 平衡正向移动,但气体的物质的量增大,故C错误;
D.使用合适的催化剂,平衡不移动,故D错误。
故答案为:B。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】已知马尔氏盐晶体[(NH4)2Fe(SO4)2·6H2O]易溶于水,不溶于乙醇,受热易分解,是分析化学中的重要试剂。回答下列问题:
(1)马尔氏盐晶体的制备:
甲组同学利用新生成的硫酸亚铁溶液与硫酸铵溶液反应制备马尔氏盐晶体(已知所使用的铁屑中含有少量的Fe2O3和FeS杂质),装置如图所示;

①为了使A中所制得的FeSO4中不含Fe3+,应使______________________过量(填化学式)。
②实验前期,需要用生成的H2将装置中的空气排尽,其原因是______________________,装置B中的试剂为____________(填写试剂名称)。
③装置A中反应一段时间后,若不拆卸装置,如何使装置A中生成的FeSO4进入装置C中,叙述操作过程____________________________________________。
(2)验证马尔氏盐晶体分解的气态产物成分:
提出假设:马尔氏盐晶体分解可能生成H2O、NH3、SO3、___________等气态化合物。
实验验证:实验小组取一定量马尔氏盐晶体隔绝空气加强热分解,利用下列裝置检验气态产物的成分(防倒吸装置已略去),试完成下表:
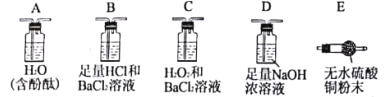
操作步骤 | 实验现象 | 结论 |
①按___→___→____顺序连接装置(填字母)。 | ②______________________ ______________________。 | 证明气体产物中含有H2O和NH3。 |
③按B→C→D顺序连接装置,其中装置B的作用是______________________。 | B中无明显现象,C中有白色沉淀生成。 | ④_____________________ ______________________。 |
【题目】某研究性学习小组通过铁与盐酸反应的实验,研究影响反应速率的因素(铁的质量相等,铁块的形状一样,盐酸均过量),甲同学设计实验如下表:
实验编号 | 盐酸浓度(mol·L-1) | 铁的状态 | 温度/°C |
1 | 2.00 | 块状 | 20 |
2 | 2.00 | 粉末 | 20 |
3 | 1.00 | 块状 | 20 |
4 | 2.00 | 块状 | 40 |
请回答:
(1)若四组实验均以收集到500mL(已转化为标准状况下)氢气为标准,则上述实验中还需要测定的数据是________。
(2)实验________和______是研究铁的状态对该反应速率的影响(填实验编号,下同);实验______和______是研究温度对该反应速率的影响。
(3)测定在不同时间t产生氢气体积V的数据,根据数据绘制得到图,则曲线c、d分别对应的实验组别可能是_______、______。

(4)乙同学设计了下列一组实验:所用铁块的形状、质量均相同,所用酸的体积相同,其浓度如下,你认为产生氢气速率最快的是______。
A 18.4mol·L-1硫酸 B 5.0mol·L-1硝酸 C 3.0mol·L-1盐酸 D 2.0mol·L-1硫酸