题目内容
在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A.无色溶液:Ca2+、Fe3+、Cl-、NO3- |
| B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- |
| C.FeCl3溶液:K+、Na+、SO42-、AlO2- |
D. mol/L的溶液:Na+、K+、SiO32-、NO3- mol/L的溶液:Na+、K+、SiO32-、NO3- |
D
解析试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。A中铁离子在溶液中显棕黄色,不能大量共存,A不正确;能使pH试纸呈红色的溶液显酸性,在酸性溶液中,NO3-能氧化I-,不能大量共存,B不正确;C中Fe3+和AlO2-水解相互促进,不能大量共存,C不正确、D中根据水的离子积常数可知,溶液中c(OH-)=0.1mol/L,即溶液显碱性,可以大量共存,答案选D。
考点:考查离子共存的正误判断
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验。有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。

 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案下列解释相关问题或实验的离子方程式不正确的是
A.NaClO溶液呈碱性:ClO—+H2O HClO+OH- HClO+OH- |
| B.向沸水中滴加饱和FeCl3溶液制胶体:Fe3++3 H2O=Fe(OH)3(胶体)+3 H+ |
| C.粗盐提纯中除去Mg2+:Mg2++2OH—=Mg(OH)2↓ |
| D.工业上精炼粗铜的阴极反应:Cu—2e—=Cu2+ |
下列离子方程式中错误的是
| A.稀氨水吸收足量SO2:NH3·H2O + SO2= NH4++ HSO3- |
| B.向Ca(ClO)2溶液中通入过量二氧化碳:ClO-+ H2O + CO2=" HClO" + HCO3- |
| C.稀硝酸中加入铁粉:2Fe + 6H+= 2Fe3++ 3H2↑ |
| D.过氧化钠与冷水反应:2Na2O2+ 2H2O = 4Na++ 4OH-+ O2↑ |
下列反应的离子方程式中,书写正确的是
| A.氯气溶于水:H2O + C12=2H+ + ClO- + Cl- |
| B.将铝粉投入氢氧化钠溶液中:2Al + 2OH-=2AlO2- + H2↑ |
| C.铁粉与氯化铁溶液反应:Fe + Fe3+=2Fe2+ |
| D.过氧化钠与水反应:2Na 2O2+ 2H2O=4Na+ + 4OH-+ O2↑ |
下列反应的离子方程式正确的是
| A.氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| B.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH4++HCO3- |
| C.用氯化铁溶液腐蚀电路板:Fe3++Cu=Fe2++Cu2+ |
| D.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
下列化学反应的离子方程式不正确的是
| A.Na2S溶液中加入少量FeCl3溶液:2Fe3++S2- = 2Fe2++S↓ |
| B.向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应:Ca2++2OH-+2HCO3- = CaCO3↓+2H2O+CO32- |
| C.向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O = SO42-+Cl-+2H+ |
D.Na2CO3溶液中滴入少量邻羟基苯甲酸溶液: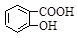 +CO32- +CO32- 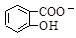 +HCO3- +HCO3- |
(12分)卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。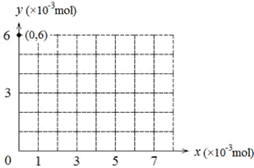
查阅资料如下:
①BrO3-+ 6I-+ 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3-+ I2 = 2IO3-+ Br2
③ IO3-+ 5I-+ 6H+ = 3I2 + 3H2O ④ 2IO3-+ 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步 骤 | 现 象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移 mol e-,该反应中硫酸表现出的化学性质是 。
(2)上述资料中的反应 (填序号)可表示步骤ⅱ中的反应,通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴,原因是 。
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(4)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
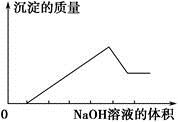
 、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是
、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是