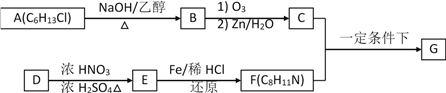题目内容
【题目】将NaCl溶液电解后通人ClO2,能得到一种高效漂白剂和氧化剂NaClO2。某同学在实验室中对此反应进行了探究。回答下列问题:
(1)配制一定物质的量浓度的NaCl溶液,除容量瓶、玻璃棒、量筒、烧杯外,还需要的玻璃仪器是_________(填名称)。
(2)ClO2是一种易溶于水而难溶于有机溶剂的气体,用亚氯酸钠固体与纯净的氯气反应可制取,反应为2NaClO2+Cl2=2ClO2+2NaCl。下图是实验室用于制备并收集一定量纯净ClO2 的装置,其连按顺序为:a→__________(按气流方向,用小写字母表示),E 装置的作用是________。

(3)探究NaClO2的氧化性及测定其纯度时进行了如下实验:
实验目的 | 操作步骤 | 现象或原因 |
1.证明NaClO2具有氧化性 | 取一定量的样品,用H2SO4酸化,再加入适量_____和KSCN 溶液检验 | 溶液显红色 |
2.测定NaClO2的纯度 | ①准确称一定质量的样品,在酸性条件下加入适量蒸馏水和足量的KI晶体 | 致溶液显黄色的离子方程式____________。 |
②取25.00mL上述待测溶液,加入________溶液做指示剂 | 反应的离子方程式:I2+2S2O32-=2I- +S4O62- | |
③用一定浓度的Na2S2O3 标准液滴定,当滴入最后一滴标准溶液时,反应达到滴定终点 | __________(用文字描述现象) |
【答案】 胶头滴管 g→h→m→n→f→e→d→c→b 除去ClO2中混有的Cl2 FeSO4 C1O2-+4I-+4H+=2H2O+2I2+Cl- 淀粉 溶液由蓝色变为无色且半分钟不变色
【解析】(1)配制一定物质的量浓度的溶液时需要用胶头滴管滴加蒸馏水定容,故配制一定物质的量浓度的NaCl溶液,除容量瓶、玻璃棒、量筒、烧杯外,还需要的玻璃仪器是胶头滴管;(2) 装置A中制取Cl2,装置F净化Cl2,纯净Cl2通入装置D中制备ClO2。因制得的ClO2中混有Cl2,用装置E吸收Cl2除杂(CCl4能吸收Cl2,而不吸收ClO2),用装置C(ClO2密度比空气大,气体需长进短出)收集气体,最后通入装置B进行尾气处理,故实验室用于制备并收集一定量纯净ClO2 的装置,其连按顺序为:a→g→h→m→n→f→e→d→c→b;E装置的作用是:除去ClO2中混有的Cl2;(3)为验证NaClO2具有氧化性,可加入FeSO4和KSCN溶液验证;测定NaClO2的纯度,可用KI与NaClO2反应生成I2,溶液显黄色的离子方程式为:C1O2-+4I-+4H+=2H2O+2I2+Cl-;加入淀粉溶液做指示剂,再用一定浓度的Na2S2O3标准液滴定I2,当滴入最后一滴标准溶液时, 溶液由蓝色变为无色且半分钟不变色,反应达到滴定终点,最后由I2的量可求得NaClO2的纯度。