题目内容
【题目】下列有关电解质溶液中的相关描叙中,不正确的是
A. 常温下,Ksp[R(OH)3]=1.0×10-38,在c(R3+)=0.010mol/L的溶液中,当pH≥2.0时R3+开始沉淀
B. 常温下,将0.1mol/LCH3COOH溶液加水稀释,当溶液的pH从3.0开到5.0时,溶液中c(CH3COO-)/(CH3COOH)的值增大到原米的100倍
C. 0.02mol/L的NaOH溶液与0.02mol/L的NaHC2O4溶液等体积混合后,则有: c(Na+)=2[c(C2O42-)+c(HC204-)+c(H2C2O4)]
D. 常温下,将1.0mol/L硫酸与amol/L氨水等体积混合至溶液呈中性,则NH4+的水解常数(Kh)计算式为=(a-1)×10-7
【答案】D
【解析】A、Ksp[R(OH)3]=1.0×10-38,在c(R3+)=0.010mol·L-1的溶液中,R3+开始沉淀时c(OH)=1.0×10-12mol·L-1,即pH≥2.0时R3+开始沉淀,选项A正确;B、根据电离平衡常数表达式可得,c(CH3COO-)/c(CH3COOH)=K/ c(H+),温度不变,K不变,c(CH3COO-)/c(CH3COOH)的值与c(H+)有关,pH从3.0升到5.0, c(H+)减小100倍,故c(CH3COO-)/c(CH3COOH)的值增大到原来的100倍,选项B正确;C、0.02 mol·L-1的NaOH溶液与0.02 mol·L-1的NaHC2O4溶液等体积混合后,溶质为Na2C2O4,根据物料守恒有c(Na+) = 2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)],选项C正确;D、根据电荷守恒:c(H+)+c(NH4+)=c(OH-)+2c(SO42-),溶液显中性, c(NH4+)= 2c(SO42-)=1mol/L,c(NH3·H2O)=(![]() -1)mol/L,NH4+的水解常数(Kh)=
-1)mol/L,NH4+的水解常数(Kh)= 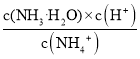 =
=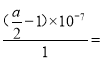
![]() ,选项D错误。答案选D。
,选项D错误。答案选D。

 每日10分钟口算心算速算天天练系列答案
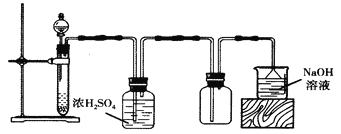
每日10分钟口算心算速算天天练系列答案【题目】将NaCl溶液电解后通人ClO2,能得到一种高效漂白剂和氧化剂NaClO2。某同学在实验室中对此反应进行了探究。回答下列问题:
(1)配制一定物质的量浓度的NaCl溶液,除容量瓶、玻璃棒、量筒、烧杯外,还需要的玻璃仪器是_________(填名称)。
(2)ClO2是一种易溶于水而难溶于有机溶剂的气体,用亚氯酸钠固体与纯净的氯气反应可制取,反应为2NaClO2+Cl2=2ClO2+2NaCl。下图是实验室用于制备并收集一定量纯净ClO2 的装置,其连按顺序为:a→__________(按气流方向,用小写字母表示),E 装置的作用是________。

(3)探究NaClO2的氧化性及测定其纯度时进行了如下实验:
实验目的 | 操作步骤 | 现象或原因 |
1.证明NaClO2具有氧化性 | 取一定量的样品,用H2SO4酸化,再加入适量_____和KSCN 溶液检验 | 溶液显红色 |
2.测定NaClO2的纯度 | ①准确称一定质量的样品,在酸性条件下加入适量蒸馏水和足量的KI晶体 | 致溶液显黄色的离子方程式____________。 |
②取25.00mL上述待测溶液,加入________溶液做指示剂 | 反应的离子方程式:I2+2S2O32-=2I- +S4O62- | |
③用一定浓度的Na2S2O3 标准液滴定,当滴入最后一滴标准溶液时,反应达到滴定终点 | __________(用文字描述现象) |