题目内容
【题目】实验室中将盛有甲烷与氯气的混合气体的量筒倒立在盛有饱和食盐水的水槽中,光照使其发生反应,下列说法错误的是( )

A. 通过量筒内壁上出现的油状液滴可以说明生成四种有机产物
B. 氯化氢极易溶于水,导致量筒中液面上升
C. 饱和食盐水能够抑制氯气的溶解
D. 量筒中气体颜色逐渐变浅
【答案】A
【解析】A、仅通过“量筒内壁上出现的油状液滴”这一实验现象并不能说明生成了四种有机产物,氯气与甲烷发生取代反应,生成的四种有机产物中CH3Cl(常温下为气体,溶于有机溶剂)、CH2Cl2、CHCl3、CCl4为油状液体,故A错误;B、氯气与甲烷反应生成HCl,而HCl极易溶于水,导致量筒内气体减少,压强减小,量筒内液面上升,故B正确;C、氯气溶于水后,部分与水反应Cl2+H2OH++Cl-+HClO,饱和食盐水中Cl-浓度较大,可以抑制Cl2的溶解,故C正确;D、氯气是黄绿色气体,当氯气被消耗,量筒内气体颜色逐渐变浅,故D正确。故选A。

 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
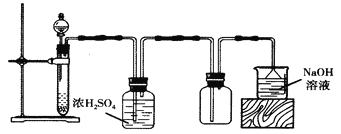
课课练江苏系列答案【题目】将NaCl溶液电解后通人ClO2,能得到一种高效漂白剂和氧化剂NaClO2。某同学在实验室中对此反应进行了探究。回答下列问题:
(1)配制一定物质的量浓度的NaCl溶液,除容量瓶、玻璃棒、量筒、烧杯外,还需要的玻璃仪器是_________(填名称)。
(2)ClO2是一种易溶于水而难溶于有机溶剂的气体,用亚氯酸钠固体与纯净的氯气反应可制取,反应为2NaClO2+Cl2=2ClO2+2NaCl。下图是实验室用于制备并收集一定量纯净ClO2 的装置,其连按顺序为:a→__________(按气流方向,用小写字母表示),E 装置的作用是________。

(3)探究NaClO2的氧化性及测定其纯度时进行了如下实验:
实验目的 | 操作步骤 | 现象或原因 |
1.证明NaClO2具有氧化性 | 取一定量的样品,用H2SO4酸化,再加入适量_____和KSCN 溶液检验 | 溶液显红色 |
2.测定NaClO2的纯度 | ①准确称一定质量的样品,在酸性条件下加入适量蒸馏水和足量的KI晶体 | 致溶液显黄色的离子方程式____________。 |
②取25.00mL上述待测溶液,加入________溶液做指示剂 | 反应的离子方程式:I2+2S2O32-=2I- +S4O62- | |
③用一定浓度的Na2S2O3 标准液滴定,当滴入最后一滴标准溶液时,反应达到滴定终点 | __________(用文字描述现象) |