题目内容
19.某温度下,在2L密闭容器中充入一定量的N2O5,发生反应:2N2O5?4NO2+O2.反应开始时,c(N2O5)=0.04mol•L-1,30s后,c(O2)=0.01mol•L-1,则N2O5的平均反应速率为( )| A. | 0.06mol•L-1•min-1 | B. | 0.001mol•L-1•s-1 | ||
| C. | 0.04mol•L-1•min-1 | D. | 0.0005mol•L-1•s-1 |
分析 先根据v=△c△t计算v(O2),再根据速率之比等于化学计量数之比计算v(N2O5).
解答 解:30s后,c(O2)=0.01mol•L-1,即氧气的浓度增加了0.01mol•L-1,v(O2)=0.01mol∙L−130s,N2O5的平均反应速率为v(N2O5)=2v(O2)=0.01mol∙L−130s×2=0.00066mol•L-1•s-1=0.04mol•L-1•min-1,故选C.
点评 本题考查化学反应速率的有关计算,比较基础,注意对公式的理解与灵活运用.

练习册系列答案
相关题目
9.如图是部分短周期元素原子序数与最外层电子数之间的关系图,下列说法中正确的是( )


| A. | 元素对应的离子半径:Z>M>R>W | |
| B. | 简单氢化物的沸点:W>R>Y>X | |
| C. | M、N、R、W的简单离子均能促进水的电离 | |
| D. | Z、X、R、W的最高价氧化物对应的水化物均能与N的单质反应 |
4.下列物质属于离子化合物的是( )
| A. | O2 | B. | H2O | C. | K2SO4 | D. | CH4 |
 表示某粒子的结构示意图.
表示某粒子的结构示意图.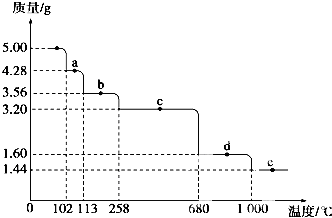 Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图:
Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图: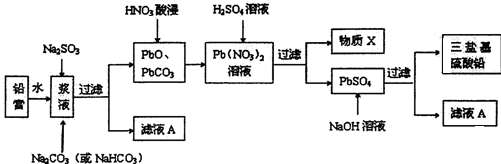

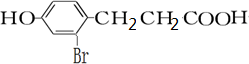 .
.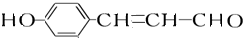 +2[Ag(NH3)2]OH
+2[Ag(NH3)2]OH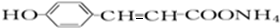 +2Ag↓+3NH3+H2O,反应类型为氧化反应.
+2Ag↓+3NH3+H2O,反应类型为氧化反应.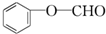 ,
,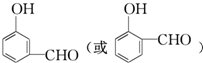 .
. +2nH2O.
+2nH2O.