题目内容
14. 右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )| A. | 电子由Ag电极经外电路流向Pt电极 | |
| B. | 空气中c(Cl2)越大,Ag极消耗速率越快 | |
| C. | 正极反应:Cl2+2e-+2Ag+═2AgCl | |
| D. | 原电池工作时电解质中Ag+数目减少 |
分析 Ag电极为负极发生氧化反应生成银离子,氯气在正极发生还原反应生成氯离子,氯离子与银离子反应生成AgCl沉淀,据沉淀质量测定氯气含量,据此分析.
解答 解:A、电子从负极Ag流向正极Pt,故A正确;
B、反应原理是Ag与氯气反应,空气中c(Cl2)越大,氯气在正极反应生成氯离子速度越快,Ag消耗越快,故B正确;
C、氯气在正极发生还原反应生成氯离子,氯离子与银离子反应生成AgCl沉淀,Cl2+2e-+2Ag+═2AgCl,故C正确;
D、电池工作时,电解质中Ag+数目不变,故D错误;
故选D.
点评 本题考查了原电池原理的应用,注意电解反应类型和电子移动方向,题目难度不大.

练习册系列答案
相关题目
4.下列推论正确的( )
| A. | SiH4的沸点高于CH4,可推测PH3的沸点也高于NH3 | |
| B. | CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体 | |
| C. | PCl3 为三角锥形,可推测NF3也为三角锥形结构 | |
| D. | C2H6的碳链是直线型的,可推测C3H8的碳链也是直线型的 |
5.下列物质递变规律不能用元素周期律解释的是( )
| A. | 非金属性:C>Si | B. | 碱性:NaOH>Mg(OH)2 | ||
| C. | 酸性:H2SO3>H2CO3 | D. | 还原性:HI>HBr |
2.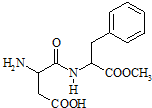 阿斯巴甜(Aspartame,结构简式如图),具有清爽的甜味,甜度约为蔗糖的200倍.下列有关阿斯巴甜说法不正确的是( )
阿斯巴甜(Aspartame,结构简式如图),具有清爽的甜味,甜度约为蔗糖的200倍.下列有关阿斯巴甜说法不正确的是( )
 阿斯巴甜(Aspartame,结构简式如图),具有清爽的甜味,甜度约为蔗糖的200倍.下列有关阿斯巴甜说法不正确的是( )
阿斯巴甜(Aspartame,结构简式如图),具有清爽的甜味,甜度约为蔗糖的200倍.下列有关阿斯巴甜说法不正确的是( )| A. | 分子式为C14H18N2O3,属于蛋白质 | |
| B. | 水解产物中有两种氨基酸 | |
| C. | 在一定条件下既能与酸反应又能与碱反应 | |
| D. | 分子中有苯环、氨基、羧基、肽键和酯的结构 |
9.如图是部分短周期元素原子序数与最外层电子数之间的关系图,下列说法中正确的是( )
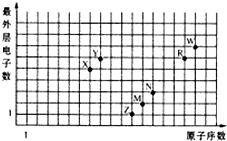

| A. | 元素对应的离子半径:Z>M>R>W | |
| B. | 简单氢化物的沸点:W>R>Y>X | |
| C. | M、N、R、W的简单离子均能促进水的电离 | |
| D. | Z、X、R、W的最高价氧化物对应的水化物均能与N的单质反应 |
6.下列指定反应的离子方程式正确的是( )
| A. | Na2O与水反应:O2-+H2O═2OH- | |
| B. | SO2使氯水褪色:SO2+Cl2+2H2O═4H++SO42-+2Cl- | |
| C. | Na2SiO3溶液与盐酸反应:Na2SiO3+2H+═H2SiO3↓+2Na+ | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+2H2O |
3.下列物质中,既有离子键又有共价键的是( )
| A. | CaCl2 | B. | KCl | C. | H2O | D. | NH4NO3 |
4.下列物质属于离子化合物的是( )
| A. | O2 | B. | H2O | C. | K2SO4 | D. | CH4 |
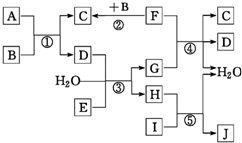 下列转化关系图中,A、B、C、D、E在常温下为气体,B、E、F为单质,其中F为黑色固体;C、D均能使澄清的石灰水变浑浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物;反应④中固态F与G的浓溶液在加热时方能发生反应.回答下列问题:
下列转化关系图中,A、B、C、D、E在常温下为气体,B、E、F为单质,其中F为黑色固体;C、D均能使澄清的石灰水变浑浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物;反应④中固态F与G的浓溶液在加热时方能发生反应.回答下列问题: