题目内容
把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如右图所示图中t1~t2速率变化的主要原因是 __________,t2~t3速率变化的主要原因是 。

镁条与盐酸的反应是放热反应,溶液温度升高,反应速率加快;盐酸浓度减小, 反应速率减慢。
试题分析:影响反应速率的因素有温度、浓度和压强以及催化剂等。所以根据图像可知,t1~t2速率变化的主要原因是镁条与盐酸的反应是放热反应,溶液温度升高,反应速率加快;t2~t3速率变化的主要原因是盐酸浓度减小,反应速率减慢。
点评:该题是常识性知识的考查,难度不大。主要是考查学生灵活运用基础知识解决实际问题的能力,有利于激发学生的学习兴趣和学习积极性。该题的关键是明确外界条件是如何影响反应速率的,然后结合图像和方程式灵活运用即可。

练习册系列答案
相关题目
 mC(g)+ nD(g);△H<0,下列说法正确的是
mC(g)+ nD(g);△H<0,下列说法正确的是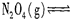



 N
N
