题目内容
(1)火箭残骸中常现红棕色气体,原因为: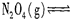

当温度升高时,气体颜色变深,则反应为 (填“吸热”或“放热”)
反应。
(2)一定温度下,上述反应的焓变为△H。现将1mol N2O4充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是 。

若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数
(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,
则0~3s内的平均反应速率v(N2O4)= mol·L-1·s-1。
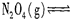

当温度升高时,气体颜色变深,则反应为 (填“吸热”或“放热”)
反应。
(2)一定温度下,上述反应的焓变为△H。现将1mol N2O4充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是 。

若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数
(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,
则0~3s内的平均反应速率v(N2O4)= mol·L-1·s-1。
(1)吸热 (2)a、d(错选、少选均不给分) 不变 0.1
试题分析:(1)火箭残骸中常现红棕色气体,原因为:
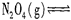
 当温度升高时,气体颜色变深,说明反应向正反应方向移动,即温度升高,平衡向正反应方向移动,故该反应的正反应方向为吸热反应;(2)1mol N2O4充入一恒压密闭容器中,该反应为反应的分子数增多,恒压,说明反应的体积逐渐增多,直到平衡,故气体的密度变小,当达到平衡时,气体的密度不变,故a正确;b中△H会发生变化,故b错误;达到平衡时反应物的反应速率与生成物的反应速率相等,故c错误,反应物的转化率随着反应的进行逐渐增多,当达到化学平衡时,转化率为一定值,故d正确,故本题的答案选择ad,温度相同,故平衡常数不变,3s后NO2的物质的量为0.6mol,则参加反应的N2O4为0.3mol,所以v(N2O4)=0.3/1/3mol·L-1·s-1)=0.1mol·L-1·s-1。
当温度升高时,气体颜色变深,说明反应向正反应方向移动,即温度升高,平衡向正反应方向移动,故该反应的正反应方向为吸热反应;(2)1mol N2O4充入一恒压密闭容器中,该反应为反应的分子数增多,恒压,说明反应的体积逐渐增多,直到平衡,故气体的密度变小,当达到平衡时,气体的密度不变,故a正确;b中△H会发生变化,故b错误;达到平衡时反应物的反应速率与生成物的反应速率相等,故c错误,反应物的转化率随着反应的进行逐渐增多,当达到化学平衡时,转化率为一定值,故d正确,故本题的答案选择ad,温度相同,故平衡常数不变,3s后NO2的物质的量为0.6mol,则参加反应的N2O4为0.3mol,所以v(N2O4)=0.3/1/3mol·L-1·s-1)=0.1mol·L-1·s-1。点评:本题考查了化学平衡状态、化学反应速率,本题要掌握温度不变,平衡常数不变,本题难度中等。

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目


 C(g)+D(g)正反应速率增大的措施是 ( )
C(g)+D(g)正反应速率增大的措施是 ( )
