题目内容
草酸作为一种重要的化工原料,某学习小组的同学拟以甘蔗渣为原料用水解一氧化一水解技术制取草酸。

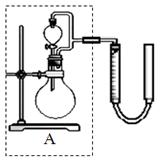
Ⅰ、步骤④是减压抽滤(见下图),其优点是:__________________________________________, 当抽滤完毕或中途停止抽滤时,为了防止自来水倒吸入B装置,最佳的操作是___________。

Ⅱ、该小组同学为了确定产品H2C2O4·xH2O中的的x值,进行下列实验:
①取w g产品配成100mL水溶液;
②量取25.00mL草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol·L-1KMnO4溶液滴定。 请回答下列问题:
(1)实验①中,需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和___________。
(2)写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:_____________________________。
(3)若滴定时,前后两次读数分别为a mL和b mL,由此计算出该草酸晶体的x值是__________
Ⅲ、该小组同学在做实验Ⅱ②时发现向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快,即反应速率由小变大。为此,他们设计了实验进行探究:
【实验用品】 仪器:试管(若干个并编号①,②,③…)、胶头滴管(若干支)、秒表
试剂:0.1 mol/L H2C2O4溶液、0.1 mol/L KMnO4溶液、稀硫酸、MnSO4固体
【实验内容】
实验(1):在①号和②号试管中分别先加入5m1 0.1mol/L H2C2O4溶液,然后各加10滴稀硫酸,且在②号试管中加入少量硫酸锰固体。再在两支试管中各加入5滴0.1mol/LKMnO4溶液。现象如下(表1)
实验(2):在①号和②号试管中分别加入5m1 0.1mol/L H2C2O4溶液,在②号试管中再滴加l0滴稀硫酸,然后在两支试管中各加入5滴0.1 mol/L 的高锰酸钾溶液。现象如下(表2)
实验(3):在①号、②号和③号试管中分别加入5m1 0.1mol/L H2C2O4溶液,然后在①、②、③号试管中依次加入10滴、l mL、2 mL稀硫酸溶液,然后各加入5滴0.1 mol/L的高锰酸钾溶液,然后置于温度为65℃的水浴中加热。观察现象如下(表3)。
(1)设计实验(1)对应的假设是_________________________________________________。
实验(1)得出的结论是____________________________________________________。
(2)由实验(2)和实验(3)得出的结论是_________________________________________m___。

Ⅰ、步骤④是减压抽滤(见下图),其优点是:__________________________________________, 当抽滤完毕或中途停止抽滤时,为了防止自来水倒吸入B装置,最佳的操作是___________。

Ⅱ、该小组同学为了确定产品H2C2O4·xH2O中的的x值,进行下列实验:
①取w g产品配成100mL水溶液;
②量取25.00mL草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol·L-1KMnO4溶液滴定。 请回答下列问题:
(1)实验①中,需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和___________。
(2)写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:_____________________________。
(3)若滴定时,前后两次读数分别为a mL和b mL,由此计算出该草酸晶体的x值是__________
Ⅲ、该小组同学在做实验Ⅱ②时发现向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快,即反应速率由小变大。为此,他们设计了实验进行探究:
【实验用品】 仪器:试管(若干个并编号①,②,③…)、胶头滴管(若干支)、秒表
试剂:0.1 mol/L H2C2O4溶液、0.1 mol/L KMnO4溶液、稀硫酸、MnSO4固体
【实验内容】
实验(1):在①号和②号试管中分别先加入5m1 0.1mol/L H2C2O4溶液,然后各加10滴稀硫酸,且在②号试管中加入少量硫酸锰固体。再在两支试管中各加入5滴0.1mol/LKMnO4溶液。现象如下(表1)
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 90s | 5 s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | |
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 100 s | 90 s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | |
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间 | 88 s | 100 s | 120 s |
| 实验现象 | 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | ||
实验(1)得出的结论是____________________________________________________。
(2)由实验(2)和实验(3)得出的结论是_________________________________________m___。
(16分)Ⅰ、加快过滤速度、得到较干燥的沉淀;慢慢打开活塞d,然后关闭水龙头; (2分+2分)
Ⅱ、(1)100mL容量瓶(1分) (2)5 H2C2O4+2MnO4- +6H+=2Mn2++10CO2↑+8H2O(2分) (3)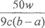 -5 (2分)
-5 (2分)
Ⅲ、(1)假设:反应产物中的Mn2+可能是反应的催化剂;(2分)
结论:Mn2+在反应中起到催化剂的作用,加快了反应速率;假设1成立。(2分)
(2)由表2和表3的实验结果可知:硫酸对草酸和高锰酸钾溶液的反应有影响。加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应,而加入大量硫酸,草酸和高锰酸钾溶液的反应速率开始比较慢,随着反应的进行,褪色速率加快;(2分)温度对该反应速率影响不大。(1分)(其他合理答案也可以酌情给分)
Ⅱ、(1)100mL容量瓶(1分) (2)5 H2C2O4+2MnO4- +6H+=2Mn2++10CO2↑+8H2O(2分) (3)
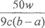 -5 (2分)
-5 (2分)Ⅲ、(1)假设:反应产物中的Mn2+可能是反应的催化剂;(2分)
结论:Mn2+在反应中起到催化剂的作用,加快了反应速率;假设1成立。(2分)
(2)由表2和表3的实验结果可知:硫酸对草酸和高锰酸钾溶液的反应有影响。加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应,而加入大量硫酸,草酸和高锰酸钾溶液的反应速率开始比较慢,随着反应的进行,褪色速率加快;(2分)温度对该反应速率影响不大。(1分)(其他合理答案也可以酌情给分)
试题分析:Ⅰ、减压抽滤的优点是加快过滤速度、得到较干燥的沉淀。当抽滤完毕或中途停止抽滤时,为了防止自来水倒吸入B装置,最佳的操作是慢慢打开活塞d,然后关闭水龙头。
Ⅱ、(1)配制100ml物质的量浓度溶液还缺少的仪器应该是100mL容量瓶。
(2)酸性高锰酸钾溶液具有强氧化性,能氧化草酸,则草酸溶液与酸性高锰酸钾溶液反应的离子方程式是5H2C2O4+2MnO4- +6H+=2Mn2++10CO2↑+8H2O。
(3)若滴定时,前后两次读数分别为a mL和b mL,则消耗高锰酸钾溶液的体积是(b-a)ml,所以根据反应的化学方程式可知
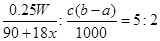 ,解得x=
,解得x=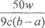 。
。Ⅲ、(1)由于在②号试管中加入少量硫酸锰固体,所以该实验的假设是反应产物中的Mn2+可能是反应的催化剂。根据实验现象可知,实验(1)得出的结论是Mn2+在反应中起到催化剂的作用,加快了反应速率;假设1成立。
(2)由表2和表3的实验结果可知,实验(2)和实验(3)得出的结论是硫酸对草酸和高锰酸钾溶液的反应有影响。加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应,而加入大量硫酸,草酸和高锰酸钾溶液的反应速率开始比较慢,随着反应的进行,褪色速率加快;但温度对该反应速率影响不大。
点评:该题是高考中的常见题型,难度大,对学生的要求高。有利于培养学生规范严谨的实验设计能力以及评价能力。该题综合性强,难点较大,对学生的要求高。本题通过陌生情景考查化学反应速、影响化学反应速率的外界因素(浓度)、学生对图表的观察、分析以及学生对实验数据的分析、整理、归纳等方面的思维能力,难度较大。解决该类试题应注意:①认真审题,明确实验目的,理解直接测量与实验目的间的逻辑和数学关系;②理解控制变量的思想在实验设计和数据分析中的运用。

练习册系列答案
相关题目


 2NH3(g) △H<0
2NH3(g) △H<0 2O3(g)△H>0
2O3(g)△H>0 NH3(g)+H2O(g)+CO2(g) △H>0
NH3(g)+H2O(g)+CO2(g) △H>0
 2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。