题目内容
【题目】在20℃时,两种气态烃和氧气的混合物装入密闭容器中点燃爆炸,又恢复到20℃,此时容器中气体压强为反应前的一半,用氢氧化钠溶液吸收后容器内几乎真空,此两种烃可能是( )
A.CH4 C6H12B.CH4 C3H4C.C2H6 C3H8D.C6H6 C2H2
【答案】B
【解析】
试题烃燃烧后的气体经NaOH溶液吸收,容器几乎成真空,说明烃和O2完全反应生成CO2和液态水,设烃的化学式为CxHy,则有CxHy+(x+ ![]() )O2
)O2 ![]() xCO2+
xCO2+ ![]() H2O(l),所以1+(x+
H2O(l),所以1+(x+![]() )=2x,即x=1+
)=2x,即x=1+![]() ,讨论:①当x=1 时,y=0舍去;②当x=2时,y=4;③当x=3时,y=8;当x大于3时不存在。则两种气态烃等效于C3H8或C2H4,并且气态烃的碳原子数小于5,排除A和D项,C项中是两种烷烃C3H8和C2H6混合,不可能等效于C3H8或C2H4,B项CH4和C3H4按1:1混合时可以等效于C2H4,故B正确。
,讨论:①当x=1 时,y=0舍去;②当x=2时,y=4;③当x=3时,y=8;当x大于3时不存在。则两种气态烃等效于C3H8或C2H4,并且气态烃的碳原子数小于5,排除A和D项,C项中是两种烷烃C3H8和C2H6混合,不可能等效于C3H8或C2H4,B项CH4和C3H4按1:1混合时可以等效于C2H4,故B正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】一个化学反应,我们不但要关心物质变化,还要研究能量变化和反应快慢。
(1)下面是一个由天然气和水反应制备氢气的反应,其方程式为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g)该反应过程中能量变化如图所示,则该反应为______反应(填“吸热”或“放热”),
CO2(g)+4H2(g)该反应过程中能量变化如图所示,则该反应为______反应(填“吸热”或“放热”),
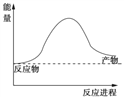
若已知,破坏1mol化学键需要吸收的热量如下表所示:则该反应吸收或放出热量为______kJ (用含a b c d字母的代数式表示)。
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |
(2)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为________;X为__________。若反应经2min达到平衡,平衡时C的浓度______0.8mol/L(填“大于”,“小于”或“等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为__________。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为________;X为__________。若反应经2min达到平衡,平衡时C的浓度______0.8mol/L(填“大于”,“小于”或“等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为__________。
【题目】I.用标准NaOH溶液滴定充满HCl的烧瓶(标况下,烧瓶容积为V L)做完喷泉实验后得到的稀盐酸(水充满整个烧瓶)以测定它的准确浓度,用酚酞作指示剂。请你回答下列问题:
(1)计算该盐酸的物质的量浓度为:_____。(保留三位有效数字)
(2)现有三种浓度的标准NaOH溶液,你认为最合适的是下列第_____种。
①5.00molL﹣1②0.500molL﹣1③0.0500molL﹣1
(3)若采用上述最合适浓度的标准NaOH溶液滴定,滴定时实验数据列表如下:
实验次数编号 | 待测盐酸体积(mL) | 滴入NaOH溶液体积(mL) |
1 | 10.00 | 8.48 |
2 | 10.00 | 8.52 |
3 | 10.00 | 8.00 |
求这种待测稀盐酸的物质的量浓度c(HCl)=_____。与理论计算值比较,造成的误差的原因可能是哪些下列操作导致的_____
①滴定前平视,滴定终了俯视
②滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡
③滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗
④看到颜色变化后立即读数 ⑤洗涤锥形瓶时,误把稀食盐水当做蒸馏水进行洗涤
II.测定绿矾FeSO4·xH2O中结晶水含量
Ⅰ.准确称量27.8 g绿矾样品,配成250 mL溶液;
Ⅱ.量取25.00 mL所配制的溶液于锥形瓶中;
Ⅲ.用硫酸酸化的0.100 0 mol·L1 KMnO4溶液滴定至终点;
Ⅳ.重复操作3次,消耗KMnO4溶液的体积分别为20.02 mL、24.98 mL、19.98 mL。
(1)判断达到滴定终点时的实验现象是_____。
(2)根据实验记录,计算绿矾化学式中结晶水数目x=__________。