题目内容
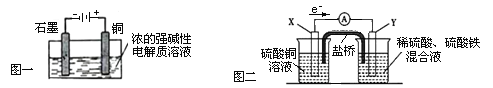
【题目】将纯锌片和纯铜片插入同浓度的稀硫酸中一段时间,下列叙述正确的是![]()

A.甲中铜片是正极,乙中铜片是负极
B.甲中铜被氧化,乙中锌被氧化
C.甲中锌片上的反应为:![]()
D.两烧杯中铜片表面均无气泡产生
【答案】C
【解析】
甲中形成铜锌原电池,锌作负极,失电子,铜作正极,![]() 在铜极上得电子,生成
在铜极上得电子,生成![]() ,总反应式为:
,总反应式为:![]() 。乙装置中只是锌片与稀硫酸间发生了置换反应:
。乙装置中只是锌片与稀硫酸间发生了置换反应:![]() ,以此进行分析。
,以此进行分析。
A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,乙中不构成原电池,铜片不是电极,故A错误;
B.甲中形成铜锌原电池,铜作正极,不参与电极反应,乙中不构成原电池,锌和氢离子直接反应,金属锌被氧化,故B错误;
C.甲中形成铜锌原电池,锌作负极,失电子,反应为:![]() ,故C正确;
,故C正确;
D.甲能形成原电池,锌作负极,失电子,铜作正极,![]() 在铜极上得电子,生成
在铜极上得电子,生成![]() ,乙不能构成原电池,在锌电极上产生气泡,故D错误;
,乙不能构成原电池,在锌电极上产生气泡,故D错误;
故选:C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】溶液中同时存在![]() 和
和![]() 四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据下表可知,下列说法错误的是( )
四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据下表可知,下列说法错误的是( )
物质 | 溶度积( |
|
|
|
|
|
|
|
|
A.Al3+最先转化为Al(OH)3沉淀
B.加碱过程中,![]() 几乎同时转化为沉淀
几乎同时转化为沉淀
C.要使Mg2+转化为沉淀,溶液pH应大于9
D.![]() 时,四种金属离子全部以沉淀形式存在
时,四种金属离子全部以沉淀形式存在