题目内容
【题目】文献表明:工业上,向炽热铁屑中通入HCl生产无水FeCl2;相同条件下,草酸根(C2O42-)的还原性强于Fe2+。某化学研究性小组进行以下实验检验这一结论并测定三草酸合铁酸钾晶体[K3Fe(C2O4)3xH2O]中草酸根含量和结晶水含量。用如图所示装置制取无水FeCl2
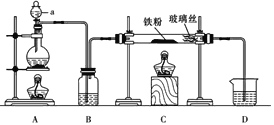
(1)仪器a的名称为___________,B中的试剂为___________。
(2)欲制得纯净的FeCl2,实验过程需先点燃A处酒精灯,原因是__________________。
(3)若用D的装置进行尾气处理,存在的问题是_______________、_________________。
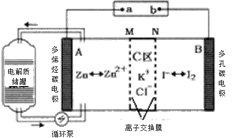
(4)某小组设计使用如图装置直接比较Fe2+和C2O42-的还原性强弱,并达到了预期的目的。
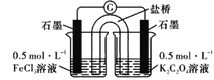
左池石墨电极为_________极,写出右池电极反应式:_______________。
(5)为测定三草酸合铁酸钾晶体中草酸根的含量和结晶水的含量,进行了如下实验:
滴定过程:①称量m g三草酸合铁酸钾晶体样品,配制成250mL溶液。
②取所配溶液25.00mL于锥形瓶中,滴加酸性KMnO4溶液滴定,恰好消耗V mL a molL-1KMnO4溶液。C2O42-被全部转化的现象是__________。
③该晶体中C2O42-的质量分数为_____________。
误差若盛放酸性KMnO4溶液的滴定管未用标准液润洗,会使结晶水x的数值_______。(填“偏高”“偏低”“无影响”)
【答案】分液漏斗 浓硫酸 用HCl排尽装置中的空气,防止铁被氧化,使产品不纯 发生倒吸 可燃性气体H2不能被吸收 正 C2O42— —2e— = 2CO2↑ 溶液由无色转变为浅紫红色,且30秒内不再变化 ![]() 偏低
偏低
【解析】
由装置图可知,在装置C中,铁与HCl发生反应生成FeCl2和氢气,则装置A用于产生HCl,可用氯化钠固体与浓硫酸加热反应制取HCl气体,通过浓硫酸干燥HCl,因加热时铁粉易被空气中的氧气氧化,且反应生成氢气,因此需先点燃A处的酒精灯排尽装置中的空气,再点燃装置C处的酒精灯,尾气的成分是剩余的HCl和生成的氢气,HCl极易溶解于水,氢气不能溶于水,导气管直接插入D装置容易引起倒吸;
(4)图示装置直接比较Fe2+和C2O42-的还原性强弱,并达到了预期的目的,证明了相同条件下,草酸根(C2O42-)的还原性强于Fe2+,根据原电池原理以及氧化还原反应进行分析;
(5)②向所配溶液中滴加酸性KMnO4溶液进行滴定时,KMnO4与C2O42-发生氧化还原反应,要说明C2O42-被全部转化,即说明KMnO4溶液过量;
③KMnO4与C2O42-发生氧化还原反应,满足关系式2MnO4-~5C2O42-,列比例计算C2O42-的质量,进而计算C2O42-的质量分数;分析若盛放酸性KMnO4溶液的滴定管未用标准液润洗,对于C2O42-含量的影响,进而分析对结晶水含量的影响。
由装置图可知,在装置C中,铁与HCl发生反应生成FeCl2和氢气,则装置A用于产生HCl,可用氯化钠固体与浓硫酸加热反应制取HCl气体,通过浓硫酸干燥HCl,因加热时铁粉易被空气中的氧气氧化,因此需先点燃A处的酒精灯排尽装置中的空气,再点燃装置C处的酒精灯,尾气的成分是剩余的HCl和生成的氢气,HCl极易溶解于水,氢气不能溶于水,导气管直接插入D装置容易引起倒吸,
(1)仪器a为分液漏斗;B中的试剂为浓硫酸,用来干燥HCl;故答案为:分液漏斗;浓硫酸;
(2)因加热时铁粉易被空气中的氧气氧化生成铁的氧化物,因此欲制得纯净的FeCl2,实验过程需先点燃A处酒精灯,用HCl排尽装置中的空气;故答案为:用HCl排尽装置中的空气,防止铁被氧化,使产品不纯;
(3)尾气的成分是剩余的HCl和生成的氢气,HCl极易溶解于水,导气管直接插入D装置中容易发生倒吸,且氢气不能溶于水,不能被吸收;故答案为:发生倒吸;可燃性气体H2不能被吸收;
(4)某小组设计使用如图装置直接比较Fe2+和C2O42-的还原性强弱,并达到了预期的目的,证明了相同条件下,草酸根(C2O42-)的还原性强于Fe2+,则该原电池反应为2Fe3++C2O42- =2Fe2++2CO2↑;则Fe3+作氧化剂得电子,被还原,则左池石墨电极为正极,右池石墨电极为负极,电极反应式为C2O42- -2e- = 2CO2↑;故答案为:正;C2O42- -2e- = 2CO2↑;
(5)②向所配溶液中滴加酸性KMnO4溶液进行滴定时,KMnO4与C2O42-发生氧化还原反应,当加入最后一滴酸性KMnO4溶液时,溶液由无色转变为浅紫红色,且30秒内不再变化,说明KMnO4溶液过量,C2O42-被全部转化;故答案为:溶液由无色转变为浅紫红色,且30秒内不再变化;
③KMnO4与C2O42-发生氧化还原反应,满足关系式2MnO4-~5C2O42-,则25.00mL溶液中![]() ,250mL溶液中n(C2O42-)=0.025aV mol,则该晶体中C2O42-的质量分数为
,250mL溶液中n(C2O42-)=0.025aV mol,则该晶体中C2O42-的质量分数为![]() ;若盛放酸性KMnO4溶液的滴定管未用标准液润洗,KMnO4溶液的浓度会偏小,则滴定C2O42-消耗的酸性KMnO4溶液的体积会偏大,则使得C2O42-的含量偏高,即K3Fe(C2O4)3的含量偏高,晶体质量一定,会使结晶水含量降低,则x的数值偏低;故答案为:
;若盛放酸性KMnO4溶液的滴定管未用标准液润洗,KMnO4溶液的浓度会偏小,则滴定C2O42-消耗的酸性KMnO4溶液的体积会偏大,则使得C2O42-的含量偏高,即K3Fe(C2O4)3的含量偏高,晶体质量一定,会使结晶水含量降低,则x的数值偏低;故答案为:![]() ;偏低。
;偏低。