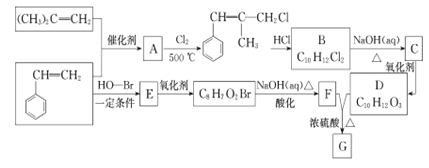
题目内容
【题目】一个化学反应,我们不但要关心物质变化,还要研究能量变化和反应快慢。
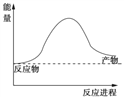
(1)下面是一个由天然气和水反应制备氢气的反应,其方程式为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g)该反应过程中能量变化如图所示,则该反应为______反应(填“吸热”或“放热”),
CO2(g)+4H2(g)该反应过程中能量变化如图所示,则该反应为______反应(填“吸热”或“放热”),
若已知,破坏1mol化学键需要吸收的热量如下表所示:则该反应吸收或放出热量为______kJ (用含a b c d字母的代数式表示)。
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |
(2)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为________;X为__________。若反应经2min达到平衡,平衡时C的浓度______0.8mol/L(填“大于”,“小于”或“等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为__________。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为________;X为__________。若反应经2min达到平衡,平衡时C的浓度______0.8mol/L(填“大于”,“小于”或“等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为__________。
【答案】 吸热 4a+4b-2c-4d 0.2mol/(L.min) 2 小于 ![]()
【解析】(1)反应过程中能量变化分析可知,反应物能量低于生成物,反应为吸热反应,CH4(g)+2H2O(g)CO2(g)+4H2(g),破坏1mol化学键需要吸收的热量结合化学方程式计算,反应吸收的热量=4a+4b-2c-4d,故答案为:吸热;4a+4b-2c-4d;
(2)反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,参加反应的A的物质的量为3mol-1.8mol=1.2mol,由方程式可知,参加反应的B为1.2mol×![]() =0.4mol,则1min内,B的平均反应速率为
=0.4mol,则1min内,B的平均反应速率为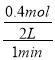 =0.2mol/(L·min);生成的C为0.4mol/L×2L=0.8mol,故1.2mol:0.8mol=3:x,解得x=2;随着反应的进行,反应速率逐渐减小,若反应经2min达到平衡,后1min的平均速率小于前1min的平均速率,前1min内C的浓度变化为0.4mol/L,则后1min内C的浓度变化小于0.4mol/L,故平衡时C的浓度小于0.8mol/L;若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0,故平衡后混合气体总的物质的量为(3mol+1mol)×
=0.2mol/(L·min);生成的C为0.4mol/L×2L=0.8mol,故1.2mol:0.8mol=3:x,解得x=2;随着反应的进行,反应速率逐渐减小,若反应经2min达到平衡,后1min的平均速率小于前1min的平均速率,前1min内C的浓度变化为0.4mol/L,则后1min内C的浓度变化小于0.4mol/L,故平衡时C的浓度小于0.8mol/L;若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0,故平衡后混合气体总的物质的量为(3mol+1mol)×![]() =
=![]() mol,故平衡后混合气体物质的量减少量为(4-
mol,故平衡后混合气体物质的量减少量为(4-![]() )mol,则:
)mol,则:
3A(g)+B(g)2C(g) 物质的量减少△n
32
n(A) (4-![]() )mol
)mol
故n(A)=(4-![]() )mol×
)mol×![]() =(6-
=(6-![]() )mol,故A的转化率=
)mol,故A的转化率=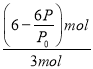 ×100%=
×100%=![]() ×100%,故答案为:0.2mol/(L·min);2;小于;
×100%,故答案为:0.2mol/(L·min);2;小于; ![]() ×100%。
×100%。

 名校课堂系列答案
名校课堂系列答案【题目】下列物质按强电解质、弱电解质、酸性氧化物、碱性氧化物的组合中,正确的是( )
强电解质 | 弱电解质 | 酸性氧化物 | 碱性氧化物 | |
A | H2SO4 | CH3COOH | NO2 | Na2O |
B | BaSO4 | HClO | Mn2O7 | CaO |
C | NaCl | 氨水 | SO2 | MnO2 |
D | HI | HF | CO2 | Fe3O4 |