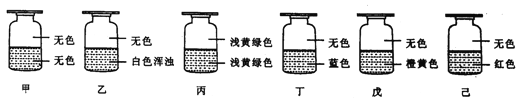
题目内容
【题目】研究发现,3D-SiC@2D-MoS2异质接面催化剂具有优异的光催化CO2用纯水的全还原性能,有效实现电子/空穴的定向迁移,最终实现CO2和H2O在相应活性位点发生氧化还原反应,如图所示。下列叙述错误的是( )
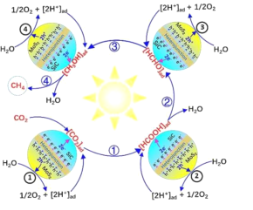
A.2D-MoS2是H2O氧化的催化剂
B.H+和e-容易在SiC@MoS2催化剂间进行反应
C.中间产物的转化“HCOOH→HCHO→CH3OH”均发生还原反应
D.总反应的方程式为CO2(g)+2H2O(g)![]() CH4(g)+2O2(g)
CH4(g)+2O2(g)
【答案】B
【解析】
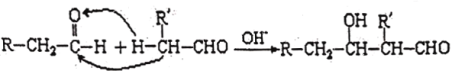
由图知①处水和二氧化碳在SiC@MoS2催化剂表面发生反应,水被氧化,变成氧气和氢离子,二氧化碳在①②③处生成中间产物 “HCOOH→HCHO→CH3OH”,均为被还原,并在 ④处反应后生成甲烷,所以图中反应物为二氧化碳和水,生成物为甲烷和氧气。
A.2D-MoS2是H2O被二氧化碳氧化的催化剂,故A正确;
B.H+和e-容易在SiC@MoS2催化剂表面进行反应,故B错误;
C.总反应的方程式为CO2(g)+2H2O(g)![]() CH4(g)+2O2(g),中间产物的转化包含“HCOOH→HCHO→CH3OH”的转化,酸被还原得到醛,醛被还原得到醇,故C正确;
CH4(g)+2O2(g),中间产物的转化包含“HCOOH→HCHO→CH3OH”的转化,酸被还原得到醛,醛被还原得到醇,故C正确;
D.上述分析得到总反应CO2(g)+2H2O(g)![]() CH4(g)+2O2(g),故D正确;
CH4(g)+2O2(g),故D正确;
故选:B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】人类生活离不开化学,以下是补铁剂和胃药的两张标签的部分信息。
硫酸亚铁片 英文名:Ferrous Sulfate Tablets 本品含硫酸亚铁(FeSO4·7H2O)应为标示量的95.0%~110.0% | 氢氧化铝片 英文名:Aluminium Hydroxide Tablets |
(主要成分)糖衣、碳酸镁、氢氧化铝、淀粉 | |
(性状)本品为糖衣,除去糖衣后显淡绿色 | (适应症)能缓解胃酸过多 |
(鉴别)取本品,除去糖衣,称取适量(约相当于硫酸亚铁片0.2g),加稀盐酸1滴与水20mL,振摇使硫酸亚铁溶解,过滤,滤液进行亚铁盐与硫酸盐的鉴别反应 | (用法用量)成人:口服,一次0.6~0.9g(一次2~3片),一日3次,餐前1小时服用 |
(详细用法)详见说明书 |
I、根据“硫酸亚铁片”标签回答问题:
(1)硫酸亚铁片溶于水后溶液的颜色是_______________。
(2)硫酸盐中检验![]() 的离子反应方程式是______________________________________。
的离子反应方程式是______________________________________。
(3)鉴别中,“加稀盐酸1滴”的作用是__________________________________________。
(4)检验硫酸亚铁片是否被氧化的方法是________________________________________。
II、根据“氢氧化铝片”标签回答问题:
(1)能缓解胃酸过多的成分是__________________________________________。
(2)氢氧化铝可作为治疗胃酸过多的内服药,这是利用了氢氧化铝的______________。
A. 酸性 B. 碱性 C. 两性 D. 氧化性
(3)写出氢氧化铝的电离方程式:_____________________________________________。