题目内容
【题目】N2(g)与H2(g)在铁催化剂表面经历如图所示过程生成NH3,下列说法正确的是
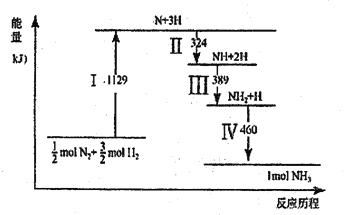
A. Ⅰ中破坏的均为极性键
B. Ⅱ、Ⅲ、Ⅳ均为放热过程
C. Ⅳ中NH2与H2生成NH3
D. N2(g)+3H2(g) ![]() 2NH3(g)ΔH>0
2NH3(g)ΔH>0
【答案】B
【解析】A.I中破坏N2和H2中的共价键是非极性键,故A错误;B. 图象中Ⅱ、Ⅲ、Ⅳ三个过程均是能量降低的变化,所以是放热过程,所以B是正确的; C. 图象中Ⅵ的变化是NH2和H生成NH3,不是NH2和H2发生的反应,故C错误;D.由图可以知道最终反应物的能量高于生成物的能量,是放热反应,因此ΔH <0, N2(g)+3H2(g) ![]() 2NH3(g)ΔH<0,故D错误;所以B选项是正确的。
2NH3(g)ΔH<0,故D错误;所以B选项是正确的。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
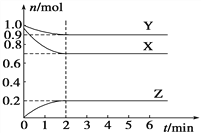
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
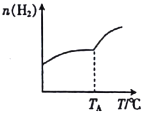
(1)其他条件不变,起始时若按1molCO2、2molH2进行投料,则CO2的转化率将____________(填“增大”“ 减小”或“不变”)。
(2)△H____________ (填“>”“<”或“不能确定”)0。
(3)若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_______(填“>” “<”或“不能确定”)H2O。
Ⅱ.甲醇是重要的化工原料,又可作为燃料,工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式以及在不同温度下的化学平衡常数如下表所示。
化学反应 |
| 500 | 700 | 800 |
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 1. 70 | 2.52 |
③3H2(g)+CO2 (g) | K3 |
请回答下列问题:
(4)根据反应比较△H1__________(填“>”“ <”或“不确定”)△H2。
(5)500℃时测得反应③在某时刻H2(g)、CO2
(6)下列措施能使反应③的平衡体系中![]() 增大的是___________(填字母)。
增大的是___________(填字母)。
A.将H2O(g)从体系中分离出去 B.充入He(g),使体系压强增大
C.升高温度 D.再充入1molH2
Ⅲ.(7)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g),请你分析该设想能否实现?_______________(填“能”或“不能”),依据是__________________。
【题目】镧系为元素周期表中第ⅢB族、原子序数为57~71的元素。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子外围电子排布图:___________。
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+ 的电子排布式为________________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3 价的元素是___________(填元素名称)。几种镧系元素的电离能(单位:kJ mol-1)
元素 | I1 | I2 | I3 | I4 |
Yb(镱) | 604 | 1217 | 4494 | 5014 |
Lu(镥) | 532 | 1390 | 4111 | 4987 |
La(镧) | 538 | 1067 | 1850 | 5419 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为________________(用元素符号表示)。
②写出氮的最简单气态氢化物水溶液中存在的氢键:__________________(任写一种)。
③元素Al 也有类似成键情况,气态氯化铝分子表示为(AlCl3)2,分子中Al 原子杂化方式为_____________,分子中所含化学键类型有______________(填字母)。
a.离子键 b.极性键 C.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,则PrO2(二氧化镨)的晶胞中有________个氧原子;已知晶胞参数为a pm,密度为ρ g· cm-3,NA=_____________ (用含a、ρ的代数式表示)。
【题目】为了提纯下列物质(括号内为杂质),所选用的除杂试剂、分离方法、必用仪器均正确的是( )
选项 | 不纯物质(杂质) | 除杂试剂或分离方法 | 必用仪器 |
A | 碘水 | 酒精、萃取 | 分液漏斗 |
B | 二氧化碳(一氧化碳) | 点燃 | |
C | 硝酸钾(氯化钠) | 直接蒸发结晶 | 蒸发皿 |
D | 乙醇(水) | 生石灰、蒸馏 | 蒸馏烧瓶 |
A.AB.BC.CD.D
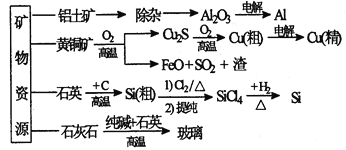
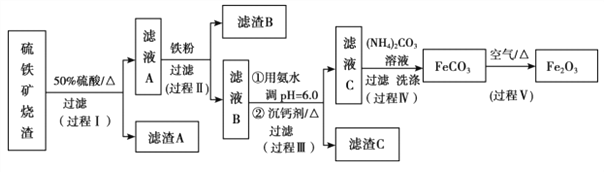
【题目】某课题组以硫铁矿烧渣(含 Fe2O3、 Fe3O4、 Al2O3、 CaO、 SiO2 等)为原料制取软磁用 Fe2O3(要求纯度>99.2%, CaO 含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
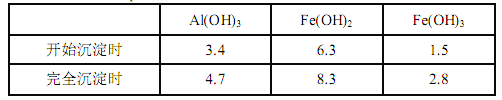
已知:生成氢氧化物的 pH 如下表所示
(1)滤渣 A 的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。
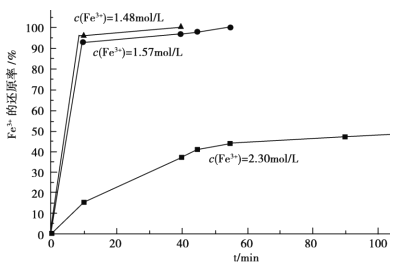
(3)在过程Ⅱ中,课题组对滤液 A 稀释不同倍数后,加入等质量的过量铁粉,得出 Fe3+浓度、还原率和反应时间的关系如图所示:结合上述实验结果说明:课题组选择稀释后c(Fe3+)为 1.60mol/L 左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:(已知:滤液 B 中钙的含量以 CaO 计为 290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果, 选择适宜的沉钙剂,得到滤渣 C 的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在 35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。