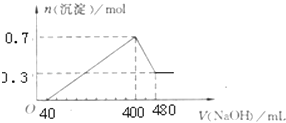
题目内容
【题目】一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
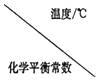
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
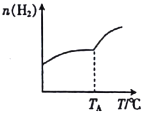
(1)其他条件不变,起始时若按1molCO2、2molH2进行投料,则CO2的转化率将____________(填“增大”“ 减小”或“不变”)。
(2)△H____________ (填“>”“<”或“不能确定”)0。
(3)若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_______(填“>” “<”或“不能确定”)H2O。
Ⅱ.甲醇是重要的化工原料,又可作为燃料,工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式以及在不同温度下的化学平衡常数如下表所示。
化学反应 |
| 500 | 700 | 800 |
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 1. 70 | 2.52 |
③3H2(g)+CO2 (g) | K3 |
请回答下列问题:
(4)根据反应比较△H1__________(填“>”“ <”或“不确定”)△H2。
(5)500℃时测得反应③在某时刻H2(g)、CO2
(6)下列措施能使反应③的平衡体系中![]() 增大的是___________(填字母)。
增大的是___________(填字母)。
A.将H2O(g)从体系中分离出去 B.充入He(g),使体系压强增大
C.升高温度 D.再充入1molH2
Ⅲ.(7)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g),请你分析该设想能否实现?_______________(填“能”或“不能”),依据是__________________。
【答案】 减小 < < < > AD 不能 反应是焓增(△H>0)、熵减(△S<0)的反应
【解析】I.(1).原为按1mol CO2和3 mol H2的物料比进行反应,其他条件不变,起始时若按1molCO2和2molH2进行投料,相当于减小了氢气的浓度,则平衡向逆反应方向移动,CO2的转化率将减小,故答案为:减小;
(2).由图可知,升高温度时,H2的物质的量增大,说明升高温度平衡逆向移动,因升高温度向吸热反应方向移动,则正反应为放热反应,△H<0,故答案为:<;
(3).若测试中体系内无氧气产生,因物质越稳定,越容易生成,根据方程式可知,产生1molC2H4的同时,有4molH2O生成,则热稳定性C2H4<H2O,故答案为:<;
II.(4).根据表中数据可知,对于反应①,升高温度K1减小,说明升高温度平衡逆向移动,则该反应是放热反应,△H1<0,对于反应②,升高温度K2增大,说明升高温度平衡正向移动,则该反应是吸热反应,△H2>0,所以△H1<△H2,故答案为:<;
(5).根据盖斯定律,①+②得反应③,所以K3=K1×K2,则500℃时K3=2.5×1.0=2.5,此时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为0.8mol·L-1、0.1mol×L-1、0.3mol·L-1、0.15mol·L-1,则Qc=![]() =0.88<K3=2.5,则反应正向进行,v(正)>v(逆),故答案为:>;
=0.88<K3=2.5,则反应正向进行,v(正)>v(逆),故答案为:>;
(6).A.将H2O(g)从体系中分离出去,减小H2O(g)的浓度,平衡正向移动,n(CH3OH)增大、n(CO2)减小,所以![]() 增大,故A正确;B.充入He(g),使体系压强增大,因不能改变平衡体系中各物质的浓度,所以平衡不移动,则
增大,故A正确;B.充入He(g),使体系压强增大,因不能改变平衡体系中各物质的浓度,所以平衡不移动,则![]() 不变,故B错误;C.根据上述分析可知,K3=K1×K2,则K3在500℃、700℃、800℃时的数值分别为:2.5、0.58、0.38,说明随温度的升高,平衡常数减小,则反应③是放热反应,则升高温度平衡逆向移动,n(CH3OH)减小、n(CO2)增大,所以
不变,故B错误;C.根据上述分析可知,K3=K1×K2,则K3在500℃、700℃、800℃时的数值分别为:2.5、0.58、0.38,说明随温度的升高,平衡常数减小,则反应③是放热反应,则升高温度平衡逆向移动,n(CH3OH)减小、n(CO2)增大,所以![]() 减小,故C错误;D. 再充入1mol H2,平衡正向移动,n(CH3OH)增大、n(CO2)减小,所以
减小,故C错误;D. 再充入1mol H2,平衡正向移动,n(CH3OH)增大、n(CO2)减小,所以![]() 增大,故D正确;答案选AD;
增大,故D正确;答案选AD;
III.(7).2CO(g)=2C(s)+O2(g)是吸热反应,△H>0,同时该反应又是熵减的反应,所以△G=△H-T△S<0,故不能实现,故答案为:不能; 反应是焓增(△H>0)、熵减(△S<0)的反应。

 同步奥数系列答案
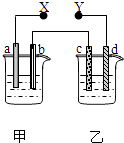
同步奥数系列答案【题目】如图X、Y分别是直流电源的两极,通电后发现a极板质量增加,d极板有无色无臭的气体放出,符合这一情况的是( )
选项 | a 极板 | d极板 | X极板 | 乙中溶液 |
A | 锌 | 铜 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
A.A
B.B
C.C
D.D