题目内容
【题目】25℃时,浓度均为 0.1 mol/L 的溶液,其 pH 如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.①和③中阴离子的总浓度:c(Cl-) + c(OH-)>c(F-) + c(OH-)
D.④中:c(![]() ) + 2c(
) + 2c(![]() ) + c(H2CO3) 0.1 mol/L
) + c(H2CO3) 0.1 mol/L
【答案】C
【解析】
NaCl不水解,故溶液显中性,CH3COONH4显中性是因为醋酸根和铵根的水解程度相同,而等浓度NaHCO3溶液的碱性强于NaF,说明酸性:H2CO3<HF。
A.NaF和NaHCO3溶液中阴离子水解显碱性,对应酸性越弱,阴离子水解程度越强,碳酸氢钠溶液pH大于NaF溶液pH,则对应酸性为H2CO3<HF,故A错误;
B.氯化钠溶液是强酸强碱溶液,溶液pH=7,氯化钠不水解,醋酸铵是弱酸弱碱盐,溶液pH=7,说明醋酸根离子和铵根离子水解程度相同,溶液显中性,①中溶质未水解,②中溶质发生双水解,故B错误;
C.氯化钠溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-);氟化钠溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(F-);故要比较两溶液阴离子总浓度,即比较阳离子总浓度,c(Na+)相等,氯化钠溶液呈中性,氟化钠溶液呈碱性,故c(H+):①>③,①和③中阴离子的总浓度:①>③,即c(Cl-) +c(OH-)>c(F-) +c(OH-),故C正确;
D.依据碳酸氢钠溶液中存在物料守恒,碳元素物质的量总量不变,④中物料守恒:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol/L,故D错误。
答案选C。

【题目】a~n10中元素在周期表中的位置如图所示,请回答下列问题:
a | ||||||||
b | c | d | e | |||||
f | g | h | m | n | ||||
…… |
(1)m的阴离子的结构示意图为___。
(2)b的最高价氧化物的化学式为___;用化学方程式表示f、d的单质形成f2d2的过程___。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___(用离子符号表示)。
(4)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。
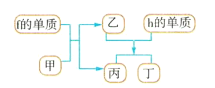
请写出h的单质与乙反应的化学方程式:___。
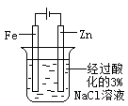
【题目】下列图示内容的对应说明正确的是
编号 | A | B | C | D |
图示 |
食盐水 |
片刻后在Fe 电极附近滴入K3[Fe(CN)6]溶液 |
|
|
说明 | 验证铁钉发生 吸氧腐蚀 | 验证 Fe 电极被保护 | 该装置是牺牲阳极的阴极保护法 | 该化学反应为放热反应 |
A.AB.BC.CD.D
【题目】在 100℃时,将 0.40 mol NO2 气体充入 2 L 的密闭容器中,发生如下反应:2NO2(g)![]() N2O4(g) H < 0。监测反应获得如下数据:
N2O4(g) H < 0。监测反应获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法正确的是
A.0~20 s 内,v(NO2) = 0.005 mol·L-1.s-1
B.若上述反应在 120℃时进行,则反应至 80 s 时,n(N2O4) < 0.08 mol
C.若仅将起始时充入 NO2 的量增至 0.80 mol,达平衡时 NO2 转化率将减少
D.59 s 时,c(NO2)一定大于 0.12 mol·L-1
【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究。
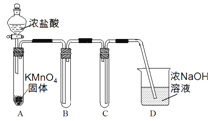
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是___________、_______________。
(2)制得的氯气中加入适量水,得到饱和氯水,饱和氯水中含氯元素的微粒有____________(写出全部微粒)。
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
①滤液漂白性增强的原因是________________(用化学平衡移动原理解释)。
②饱和氯水与石灰石反应生成HC1O的方程式是___________________。
Ⅱ. ClO3—、Cl—和H+反应的探究
(4)KClO3、KCl与硫酸可以反应。该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | (____)mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的_______________________。
②烧杯3取用硫酸的体积应为______________mL。
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2______________________。