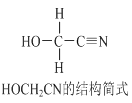
题目内容
【题目】如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。下列判断不正确的是
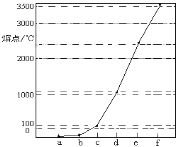
A.图中对应的e、f单质晶体熔化时克服的是共价键
B.第二电离能:c>d
C.b元素形成的最高价含氧酸易与水分子之间形成氢键
D.单质a、b、f对应的元素以原子个数比1∶1∶1形成的最简单分子中含2个σ键和2个π键
【答案】B
【解析】
Na、Cu、Si、 H、C. N等元素单质中,Na、Cu为金属晶体,均是热和电的良导体,C、Si的单质为原子晶体,且C单质的熔沸点大于Si原子晶体的熔点,H、N对应的单质为分子晶体,其中氢气的熔点最低,由图熔点的高低顺序可知a为H,b为N,c为Na,d为Cu,e为Si,f为C,据此分析解答
A.e为Si,f为C,对应的单质为原子晶体,存在共价键,故A正确;
B.c为Na,d为Cu,铜失去一个电子后形成的全满状态,第二电离能c<d,故B错误;
C.b为N,元素形成的最高价含氧酸中含有O- H键,易与水分子之间形成氢键,故C正确;
D.单质a、b、f对应的元素以原子个数比1:1:1形成的分子为HCN,结构式为H-C≡N,分子中含2个σ键2个π键,故D正确;
故答案:B。

练习册系列答案
相关题目
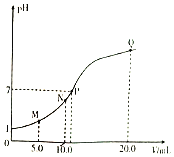
【题目】25℃时,浓度均为 0.1 mol/L 的溶液,其 pH 如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.①和③中阴离子的总浓度:c(Cl-) + c(OH-)>c(F-) + c(OH-)
D.④中:c(![]() ) + 2c(
) + 2c(![]() ) + c(H2CO3) 0.1 mol/L
) + c(H2CO3) 0.1 mol/L