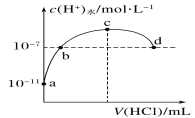
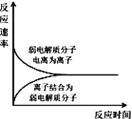
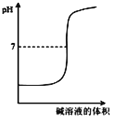
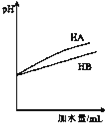
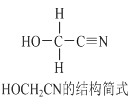
题目内容
【题目】下列有关 2 个电化学装置的叙述不正确的是
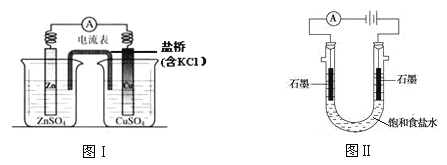
A.图Ⅰ,在不改变总反应的前提下,可用 Na2SO4 替换 ZnSO4,用石墨替换 Cu 棒
B.图Ⅰ,电流形成的完整过程是:负极 Zn-2e-=Zn2+,电子经导线流向正极,正极 Cu2++2e-=Cu
C.图Ⅱ,通电后向两极滴加酚酞,左侧变红
D.图Ⅰ,盐桥中 Cl-向左侧移动,图Ⅱ,溶液中 Cl-向右侧移动
【答案】B
【解析】
A.将图Ⅰ中的ZnSO4替换为Na2SO4,对左侧区反应无影响,将Cu棒替换为石墨棒,仍然时锌为负极,Cu为正极,故并不改变总反应,故A正确;
B.图Ⅰ中电流形成的完整过程是:负极Zn-2e-=Zn2+,外电路中电子经导线流向正极,正极Cu2++2e-=Cu,内电路的盐桥中的阴离子移向负极,阳离子移向正极,故B错误;
C.图Ⅱ中左侧区时阴极,电极反应为![]() ,故阴极区显碱性,加酚酞后溶液变红,故C正确;
,故阴极区显碱性,加酚酞后溶液变红,故C正确;
D.图Ⅰ中左侧为负极,故盐桥中Cl-向左侧移动,图Ⅱ中右侧时阳极,故溶液中Cl-向右侧移动,故D正确;
故答案为:B。

练习册系列答案
相关题目
【题目】25℃时,浓度均为 0.1 mol/L 的溶液,其 pH 如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.①和③中阴离子的总浓度:c(Cl-) + c(OH-)>c(F-) + c(OH-)
D.④中:c(![]() ) + 2c(
) + 2c(![]() ) + c(H2CO3) 0.1 mol/L
) + c(H2CO3) 0.1 mol/L