题目内容
【题目】在 100℃时,将 0.40 mol NO2 气体充入 2 L 的密闭容器中,发生如下反应:2NO2(g)![]() N2O4(g) H < 0。监测反应获得如下数据:
N2O4(g) H < 0。监测反应获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法正确的是
A.0~20 s 内,v(NO2) = 0.005 mol·L-1.s-1
B.若上述反应在 120℃时进行,则反应至 80 s 时,n(N2O4) < 0.08 mol
C.若仅将起始时充入 NO2 的量增至 0.80 mol,达平衡时 NO2 转化率将减少
D.59 s 时,c(NO2)一定大于 0.12 mol·L-1
【答案】B
【解析】
A.0~20 s内,v(N2O4)=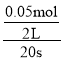 =0.00125 molL-1s-1,根据速率之比等于对应物质的化学计量数之比,所以v(NO2)=0.0025 molL-1s-1,故A错误;
=0.00125 molL-1s-1,根据速率之比等于对应物质的化学计量数之比,所以v(NO2)=0.0025 molL-1s-1,故A错误;
B.2NO2(g)![]() N2O4(g) H < 0,正反应是放热反应,升高温度平衡向逆反应方向移动,所以反应在120℃时进行,则反应至80 s时,n(N2O4)<0.08 mol,故B正确;
N2O4(g) H < 0,正反应是放热反应,升高温度平衡向逆反应方向移动,所以反应在120℃时进行,则反应至80 s时,n(N2O4)<0.08 mol,故B正确;
C.若仅将起始时充入NO2的量增至 0.80 mol,增大了NO2的物质的量,容器体积不变,体系压强增大,平衡右移,所以NO2的转化率升高,故C错误;
D.60 s时△n(N2O4)=0.08mol,所以60s时△n(NO2)=0.16mol,如果59 s未平衡,n(NO2)>0.40-0.16=0.24 mol,则c(NO2)大于0.12 molL-1;若59s时达到平衡状态,则c(NO2)等于0.12 molL-1,所以59 s 时,c(NO2)可能大于0.12 mol·L-1,故D错误;
答案选B。

【题目】常温下,向如图所示的两个容积相同的刚性容器中分别充入气体M、N(如表所示),使两容器中压强相等。打开开关k,两容器中的气体充分混合后,恢复至常温,容器内的气体压强(固体影响忽略不计)由大到小的顺序正确的是 ( )
装置 | 编号 |
|
|
|
|
| M | NH3 | HI | NO | H2 |
N | Cl2 | Cl2 | O2 | O2 |
A.①=④>②=③ B.①=④>②>③
C.④>①>②>③D.①>④>②>③
【题目】25℃时,浓度均为 0.1 mol/L 的溶液,其 pH 如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.①和③中阴离子的总浓度:c(Cl-) + c(OH-)>c(F-) + c(OH-)
D.④中:c(![]() ) + 2c(
) + 2c(![]() ) + c(H2CO3) 0.1 mol/L
) + c(H2CO3) 0.1 mol/L