题目内容
12.现有如下2FeCl3+Cu═2FeCl2+CuCl2,请根据该反应的实质,设计成原电池,在下面方框中画出装置图并标出正、负极材料、电解质溶液及书写电极反应式
电极反应式:负极:Cu-2e-═Cu2+正极:2Fe3++2e-═2Fe2+.
分析 根据电池反应式知,Cu失电子发生氧化反应作负极、不如Cu活泼的金属或导电的非金属作正极,FeCl3溶液为电解质溶液;负极上Cu失电子发生氧化反应、正极上铁离子得电子发生还原反应,据此分析.
解答 解:根据电池反应式知,Cu失电子发生氧化反应作负极、不如Cu活泼的金属或导电的非金属作正极,FeCl3溶液为电解质溶液,则该原电池为负极上Cu失电子发生氧化反应、正极上铁离子得电子发生还原反应,则负极反应式为Cu-2e-═Cu2+,正极反应式为2Fe3++2e-═2Fe2+, ,故答案为:
,故答案为: ;Cu-2e-═Cu2+;2Fe3++2e-═2Fe2+.
;Cu-2e-═Cu2+;2Fe3++2e-═2Fe2+.
点评 本题考查原电池设计,会根据电池反应式确定正负极及电解质,发生氧化反应的金属作负极、不如负极材料活泼的金属或导电的非金属作正极,发生还原反应的电解质为原电池中电解质,会正确书写电极反应式,为高考高频点.

练习册系列答案
相关题目
9.质量比为2:3的铝分别与足量的盐酸和足量的氢氧化钠溶液反应,放出氢气在相同条件下的体积比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:3 |
20.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| C. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 |
7.甲烷分子是以碳原子为中心的正四面体结构而不是正方形的平面结构,其理由是( )
| A. | CHCl3只有一种结构 | |
| B. | CH2Cl2只有一种结构 | |
| C. | CH4是非极性分子 | |
| D. | CH4的四个价键的键长和键能都相等 |
17.化学与社会、生活密切相关.下列说法正确的是( )
| A. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| B. | 大豆富含蛋白质,故豆浆煮沸后蛋白质变成了氨基酸 | |
| C. | 石油的分馏、煤的气化、海水提溴的过程都包含化学变化 | |
| D. | 地淘油经处理后可作为汽车燃油,故地沟油的成分是液态烃 |
1.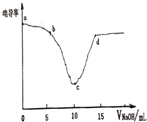 电导率可用于衡量电解质溶液的导电能力,即电导率越大,则溶液的导电能力越强.利用电导率传感器测得用0.100mol/L的NaOH溶液滴定10.00mL0.100mol/L的盐酸,电导率曲线如图所示.下列说法不正确的是( )
电导率可用于衡量电解质溶液的导电能力,即电导率越大,则溶液的导电能力越强.利用电导率传感器测得用0.100mol/L的NaOH溶液滴定10.00mL0.100mol/L的盐酸,电导率曲线如图所示.下列说法不正确的是( )
 电导率可用于衡量电解质溶液的导电能力,即电导率越大,则溶液的导电能力越强.利用电导率传感器测得用0.100mol/L的NaOH溶液滴定10.00mL0.100mol/L的盐酸,电导率曲线如图所示.下列说法不正确的是( )
电导率可用于衡量电解质溶液的导电能力,即电导率越大,则溶液的导电能力越强.利用电导率传感器测得用0.100mol/L的NaOH溶液滴定10.00mL0.100mol/L的盐酸,电导率曲线如图所示.下列说法不正确的是( )| A. | d点溶液中:c(Cl-)=2c(OH-)-2c(H+) | |
| B. | 电导率传感器能用于酸碱中和滴定终点的判断 | |
| C. | c点电导率最小是因为c点溶液的溶质为弱电解质 | |
| D. | c(Na+)、c(Cl-)对导电能力的影响比c(H+)、c(OH-)对导电能力的影响小 |
2.在元素周期表中,在金属与非金属的分界线附近可找到( )
| A. | 新型催化剂 | B. | 新型农药 | ||
| C. | 半导体材料 | D. | 耐腐蚀的合金材料 |
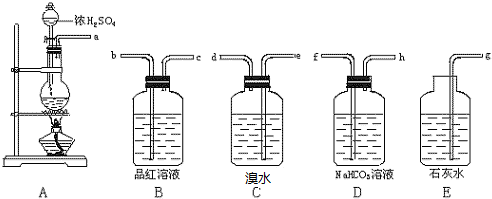
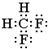 ;下列对于乙的描述正确的是d.
;下列对于乙的描述正确的是d.