题目内容
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2=2NH3为放热反应:
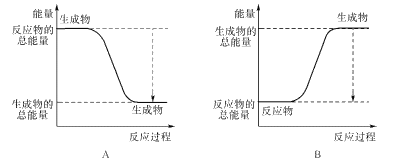
①下图能正确表示该反应中能量变化的是____;
②根据下表数据,计算生成1 molNH3时该反应放出的热量为____kJ;

③一定温度下,将3 molH2和1 molN2通入容积为2L的密闭容器中发生反应,5 min达到平衡,测得c(NH3)=0.6 mol/L,则0至5 min时v(N2)=___,达到平衡时H2的转化率为____。
(2)某兴趣小组为研究原电池原理,设计如图装置。
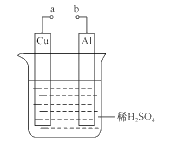
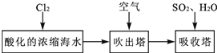
①a和b用导线连接,Cu极为原电池____极(填“正”或“负”),电极反应式是____;Al极发生____(填“氧化”或“还原”)反应,其电极反应式为____,溶液中SO42-移向____(填“Cu”或“Al”极)。溶液pH____(填增大或减小);当负极金属溶解5.4g时,____NA电子通过导线。
②不将a、b连接,请问如何加快Al与稀硫酸的反应速率?_______________
【答案】 A 46 0.06mol/(L·min) 60% 正 2H++2e-=H2↑ 氧化 Al-3e-=Al3+ Al 增大 0.6 往溶液里滴入少量硫酸铜溶液;或将铜棒直接靠在铝棒上
【解析】(1)①根据反应放热判断;
②根据ΔH=反应物的化学键断裂吸收的能量-生成物的化学键形成释放的能量计算;
③根据反应速率之比是化学计量数之比计算;根据氢气的消耗量和起始量计算转化率;
(2)①原电池中较活泼的金属是负极,失去电子,发生氧化反应,正极发生得到电子的还原反应,据此判断。
②根据原电池可以加快反应速率分析。
(1)①由于该反应是放热反应,则反应物的总能量高于生成物的总能量,A符合;
②根据键能可知该反应的反应热△H=(3×436+956-2×3×391)kJ/mol=-92kJ/mol,所以生成1 molNH3时该反应放出的热量为46kJ;
③一定温度下,将3 molH2和1 molN2通入容积为2L的密闭容器中发生反应,5 min达到平衡,测得c(NH3)=0.6 mol/L,则用氨气表示的反应速率是0.6mol/L÷5min=0.12 mol/(L·min)。又因为反应速率之比是化学计量数之比,则0至5 min时v(N2)= 0.12 mol/(L·min)÷2=0.06mol/(L·min);达到平衡时生成氨气是0.6mol/L×2L=1.2mol,根据方程式可知消耗氢气是1.8mol,则H2的转化率为1.8mol/3mol×100%=60%。
(2)①a和b用导线连接构成原电池,铝的金属性强于铜,则Cu极为原电池正极,溶液中的氢离子放电,电极反应式是2H++2e-=H2↑;Al极是负极,发生失去电子的氧化反应,其电极反应式为Al-3e-=Al3+,溶液中SO42-移向负极,即向Al电极移动;由于正极氢离子放电,则溶液pH增大;当负极金属溶解5.4g时,即消耗金属铝是5.4g÷27g/mol=0.2mol,则有0.6NA电子通过导线。
②如果不将a、b连接,要加快Al与稀硫酸的反应速率,根据原电池的工作原理可知可以采取的措施是往溶液里滴入少量硫酸铜溶液或将铜棒直接靠在铝棒上。

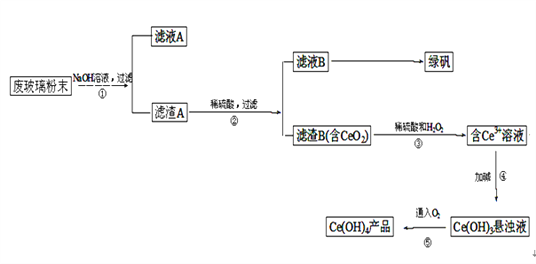
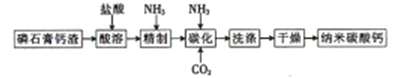
【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:
已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有______。(回答两条即可)
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为_______。

(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去________ (填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式_______(填化学式);碳化时发生反应的化学方程式为______。
(5)把CaCO3浊液滴入1.0molL-1 的Na2SO3溶液中,能否产生CaSO3沉淀?_______。若不能,说明原因;若能,请从定量的角度简述判断依据:_______。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9]
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:__________。
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g100ml﹣1).
(1)Ⅰ.实验步骤:
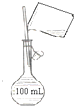
用(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到转移到 (填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
(3)读取盛装0.1000mol/L NaOH溶液的碱式滴定管的初始读数.
滴定.当时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
(4)Ⅱ.实验记录:
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积V= ![]() mL=15.24mL.指出他的计算的不合理之处: .
mL=15.24mL.指出他的计算的不合理之处: .
(5)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子交换反应,需查找在一定温度下醋酸和苯甲酸的(填写序号)
a.电离常数 b.溶解度
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号) .
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.