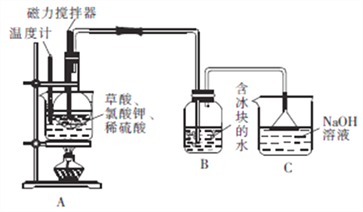
题目内容
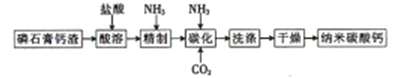
【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:
已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有______。(回答两条即可)
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为_______。

(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去________ (填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式_______(填化学式);碳化时发生反应的化学方程式为______。
(5)把CaCO3浊液滴入1.0molL-1 的Na2SO3溶液中,能否产生CaSO3沉淀?_______。若不能,说明原因;若能,请从定量的角度简述判断依据:_______。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9]
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:__________。
【答案】 粉碎磷石膏钙渣,增大盐酸浓度,适当升高温度,延长酸溶时间等(任写两条) 4.0 molL-1(填4.0mol/L左右均可) Fe3+、Al3+ NH3 CaCl2+H2O+2NH3+CO2=CaCO3↓+2NH4Cl 能 由![]() =50 可知,当CaSO3与CaCO3 的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变 略
=50 可知,当CaSO3与CaCO3 的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变 略
【解析】(1)磷石膏钙渣进行酸溶时,为了提高溶出率,可以采取粉碎磷石膏钙渣,增大盐酸浓度,适当升高温度,延长酸溶时间等方法;正确答案:粉碎磷石膏钙渣,增大盐酸浓度,适当升高温度,延长酸溶时间等(任写两条)。
(2)根据图像可知,盐酸的浓度控制在4.0mol·L-1时或左右,钙溶出率较高;正确答案:4.0mol·L-1(填4.0mol·L-1左右均可)
(3)磷石膏钙渣进行酸溶时,溶液中存在铁离子、铝离子等杂质离子,因此,向粗制CaCl2溶液中通入氨气,控制溶液的pH,把Fe3+、Al3+变为沉淀而除去;正确答案:Fe3+、Al3+。
(4)二氧化碳易与含有氨气的碱性CaCl2溶液反应,有利于反应的顺利进行,生成碳酸钙沉淀和氯化铵,反应为:CaCl2+H2O+2NH3+CO2=CaCO3↓+2NH4Cl,因此先通入气体为NH3;正确答案:NH3 ; CaCl2+H2O+2NH3+CO2=CaCO3↓+2NH4Cl。
(5)由![]() =c(Ca2+)×c(SO32-)/c(Ca2+)×c(CO32-)=c(SO32-)/c(CO32-)=1.4×10-7/2.8×10-9=50,c(SO32-)/c(CO32-)=50, 当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变; 正确答案:能;由
=c(Ca2+)×c(SO32-)/c(Ca2+)×c(CO32-)=c(SO32-)/c(CO32-)=1.4×10-7/2.8×10-9=50,c(SO32-)/c(CO32-)=50, 当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变; 正确答案:能;由![]() =50可知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变。
=50可知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变。
(6)碳酸钙样品颗粒为纳米级时,其水溶液为胶体,可以用丁达尔效应进行检验;具体操作:取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是;正确答案:取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是。

 津桥教育计算小状元系列答案
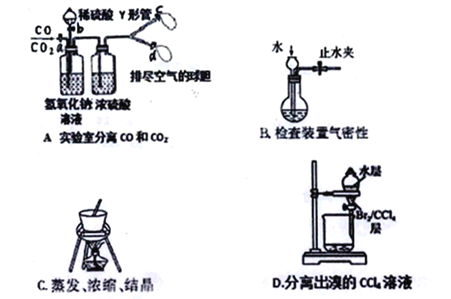
津桥教育计算小状元系列答案【题目】下列物质提纯的方案错误的是
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A | CO | CO2 | NaOH溶液,浓H2SO4 | 洗气 |
B | CO2 | HCl | NaOH溶液 | 过滤 |
C | Cl2 | HCl | 饱和食盐水,浓H2SO4 | 洗气 |
D | Na2CO3固体 | NaHCO3固体 | —— | 加热 |
A.AB.BC.CD.D