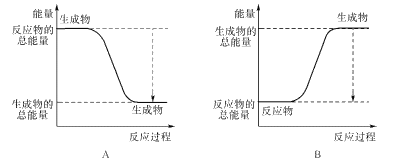
题目内容
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料,设计资源回收的工艺流程如下:
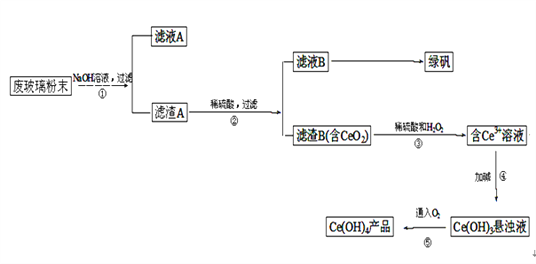
(1)写出第①步反应的离子方程式___________________________________________。
(2)洗涤滤渣B的目的是为了除去______(填离子符号),
(3)写出第③步反应的化学方程式_________________________。
(4)制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量_______,(物质名称)充分反应后,经过滤得到FeSO4溶液,再经________、________、过滤、洗涤、干燥等操作步骤得到绿矾。
(5)取上述流程中得到的Ce(OH)4产品(质量分数为80%)1.300g,加硫酸溶解后,用 0.1000mol/L FeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为________mL。
【答案】 SiO2+2OH-=SiO32-+H2O Fe3+ 2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O 铁粉 蒸发浓缩 冷却结晶 50.00
【解析】(1)玻璃粉末中的SiO2能与NaOH溶液反应,离子方程式为:SiO2+2OH-=SiO32-+H2O。
(2)滤渣B表面吸附有可溶性离子:SO42-、Fe3+,Fe3+与Ce3+能一起沉淀,导致产品不纯,故洗涤的目的是除去Fe3+。
(3)CeO2和H2O2在稀硫酸的条件下发生氧化还原反应,+4价的Ce被还原为+3 的Ce,则H2O2作还原剂,被氧化为O2,化学方程式为:2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O。
(4)向Fe2(SO4)3溶液中加入过量铁粉反应生成FeSO4,过滤后得到FeSO4溶液,再经过蒸发浓缩、冷却结晶,即可得到绿矾晶体。
(5)根据题意写出相关反应的离子方程式:Ce(OH)4+4H+=Ce4++4H2O、Ce4++Fe2+=Ce3++Fe3+,根据以上两个方程式可得Ce(OH)4 ~Fe2+,所以n(FeSO4)=n(Ce(OH)4)= 1.300g×80%÷208g/mol =0.005mol,需要FeSO4溶液体积V=0.005mol÷0.1000mol/L=50.00ml。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】下列物质提纯的方案错误的是
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A | CO | CO2 | NaOH溶液,浓H2SO4 | 洗气 |
B | CO2 | HCl | NaOH溶液 | 过滤 |
C | Cl2 | HCl | 饱和食盐水,浓H2SO4 | 洗气 |
D | Na2CO3固体 | NaHCO3固体 | —— | 加热 |
A.AB.BC.CD.D
【题目】学习化学有利于我们认识饮食与健康的关系,养成良好的饮食习惯.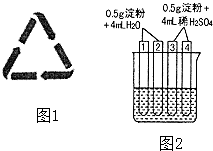
(1)油脂被摄人人体后,在酶的作用下水解为(写名称,下同)和 , 进而被氧化生成并提供能量,或作为合成人体所需其他物质的原料.
(2)发育出现障碍,患营养缺乏症,这主要是由于摄取(填“蛋白质”、“脂肪”或“糖类”)不足引起的.下列食物中富含该物质的是 (填字母).
A菠菜 B花生油 C瘦肉 D西瓜
(3)某火腿制品的包装上印有相关配料:精选瘦肉、白糖、淀粉、亚硝酸钠等.火腿中属于防腐剂的是 , 不可长期或大量进食腌制肉类食品的原因是:其包装袋上常可看到如图1所示的图标,它的含义是 , 此包装袋材料是聚乙烯塑料,它的单体是(填结构简式).
(4)如图2所示4支试管同时水浴加热4min.为检验其中淀粉的水解程度,某同学的实验操
作与现象记录如下:
试管 | 操作 | 现象 |
① | 加入碘水 | 溶液变成蓝色 |
② | 加入银氨溶液,水浴加热 | 未出现银镜 |
③ | 加入碘水 | 溶液变成蓝色 |
④ | 加入银氨溶液,水浴加热 | 未出现银镜 |
①结合试管1、2中的现象,得出的结论是:这两支试管中淀粉水解(填“没有”、“部分”或“全部”),淀粉 (填“有”或“没有”)还原性.
②结合试管3、4中的现象,(填“能”或“不能”)得出“这两支试管中淀粉没有水解”的结论,理由是 .