题目内容
11.下列离子方程式正确的是( )| A. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | Fe(OH)3溶液氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ |
分析 A.发生氧化还原反应生成硫酸钙;
B.发生氧化还原反应生成碘化亚铁、碘和水;
C.遵循电子、电荷守恒;
D.发生氧化还原反应生成硫酸钠.
解答 解:A.少量SO2通入Ca(ClO)2溶液中的离子反应为SO2+H2O+Ca2++3ClO-═CaSO4↓+Cl-+2HClO,故A错误;
B.Fe(OH)3溶液氢碘酸的离子反应为2I-+2Fe(OH)3+6H+═2Fe2++I2+6H2O,故B错误;
C.铜溶于稀硝酸的离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故C正确;
D.Na2S2O3溶液中通入足量氯气的离子反应为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应的离子反应考查,注意电子、电荷守恒分析,题目难度不大.

练习册系列答案
相关题目
2.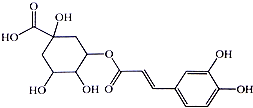 银翘的金银花与连翘配成的中成药,具有辛凉解表,清热解毒,用于流行感冒引起的发热、咳嗽、口干、咽喉肿痛.其中的一种具有较广泛的杀菌作用的有效成分--绿原酸,结构简式见图.下列描述错误的是( )
银翘的金银花与连翘配成的中成药,具有辛凉解表,清热解毒,用于流行感冒引起的发热、咳嗽、口干、咽喉肿痛.其中的一种具有较广泛的杀菌作用的有效成分--绿原酸,结构简式见图.下列描述错误的是( )
 银翘的金银花与连翘配成的中成药,具有辛凉解表,清热解毒,用于流行感冒引起的发热、咳嗽、口干、咽喉肿痛.其中的一种具有较广泛的杀菌作用的有效成分--绿原酸,结构简式见图.下列描述错误的是( )
银翘的金银花与连翘配成的中成药,具有辛凉解表,清热解毒,用于流行感冒引起的发热、咳嗽、口干、咽喉肿痛.其中的一种具有较广泛的杀菌作用的有效成分--绿原酸,结构简式见图.下列描述错误的是( )| A. | 绿原酸有可能通过酯化反应人工合成 | |
| B. | 1mol绿原酸能与4molBr2发生加成反应 | |
| C. | 1mol绿原酸能与6molNa发生置换反应 | |
| D. | 绿原酸能与NaHCO3溶液发生反应放出CO2 |
19.将质量百分比浓度为a%,物质的量浓度为C1 mol/L的稀硫酸蒸发掉一定量的水,使之质量百分比浓度为2a%,物质的量浓度为C2 mol/L,则C1和C2的关系是( )
| A. | C2=2C1 | B. | C2>2C1 | C. | C2<2C1 | D. | C1=2C2 |
6.已知,还原性Fe>Cu>Fe2+.将m g铁放入含有a mol FeCl3和b mol CuCl2的混合溶液中,充分反应后,固体粉末仍为m g.则a:b可能是( )
| A. | 8:7 | B. | 2:7 | C. | 1:1 | D. | 1:5 |
16.在泡沫制作过程中,有反应2H2O2═2H2O+O2↑,下列说法正确的是( )
| A. | H2O2既是氧化剂又是还原剂 | B. | H2O2是氧化剂 | ||
| C. | O2既是氧化产物又是还原产物 | D. | 该反应转移4mole- |
16.某二元弱酸H2A,在溶液中可以发生一级和二级电离:H2A?H++HA-,HA-?H++A2-,已知相同浓度时H2A比HA-容易电离,在相同温度时下列溶液中H2A浓度最大的是( )
| A. | 0.01 mol/L的H2A溶液 | |
| B. | 0.01 mol/L的NaHA溶液 | |
| C. | 0.02 mo|/L的NaOH溶液与0.02 mol/L的NaHA溶液等体积混合 | |
| D. | 0.02 mol/L的HCl溶液与0.04 mol/L的NaHA溶液等体积混合 |
17.下列说法中正确的是( )
| A. | 形成离子键的阴、阳离子间只存在静电吸引力 | |
| B. | 核外电子排布相同的微粒,化学性质相同 | |
| C. | 所有物质中均存在化学键 | |
| D. | 离子化合物中一定含有离子键 |