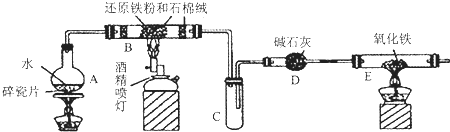
题目内容
6.已知,还原性Fe>Cu>Fe2+.将m g铁放入含有a mol FeCl3和b mol CuCl2的混合溶液中,充分反应后,固体粉末仍为m g.则a:b可能是( )| A. | 8:7 | B. | 2:7 | C. | 1:1 | D. | 1:5 |
分析 已知还原性:Fe>Cu>Fe2+,则氧化性:Fe3+>Cu2+>Fe2+,加入铁粉后先发生反应:2FeCl3+Fe=3FeCl2,amol氯化铁完全反应消耗0.5amol铁粉,该反应中固体质量只减少,减少的铁粉的质量为:56g/mol×0.5amol=28ag;
当铁离子完全反应后,发生反应:CuCl2+Fe=Cu+FeCl2,△m
1mol 8g,
n 28ag,
则:n=$\frac{28ag×1mol}{8g}$=$\frac{7}{2}$amol,
当氯化铜完全反应时,则b=n=$\frac{7}{2}$amol,则:a:b=2:7;当反应后氯化铜有剩余时,则b>n>$\frac{7}{2}$amol,则a:b<2:7,据此进行判断.
解答 解:还原性Fe>Cu>Fe2+,则氧化性:Fe3+>Cu2+>Fe2+,加入铁粉后先发生反应:2FeCl3+Fe=3FeCl2,amol氯化铁完全反应消耗0.5amol铁粉,该反应中固体质量只减少,减少的铁粉的质量为:56g/mol×0.5amol=28ag,
当铁离子完全反应后,发生反应:CuCl2+Fe=Cu+FeCl2,△m
1mol 8g,
n 28ag,
则:n=$\frac{28ag×1mol}{8g}$=$\frac{7}{2}$amol,
当氯化铜完全反应时,则b=n=$\frac{7}{2}$amol,则:a:b=2:7,故B正确;
当反应后氯化铜有剩余时,则b>n>$\frac{7}{2}$amol,则a:b<2:7,故D正确;
故选BD.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握差量法、讨论法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案(1)下表列举了不同温度下大气固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2000 |
| K | 3.84×10-31 | 0.1 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
(2)工业固氮反应是:N2 (g)+3H2 (g)?2NH3(g)△H=-92.4kJ/mol.在相同温度下,体积均为0.25L的两个恒容密闭容器中可发生上述可逆反应,测得反应的有关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系的 能量变化 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 放热23.1kJ |
| b | 0.6 | 1.8 | 0.8 | 吸热Q kJ |
②容器b达平衡时NH3的平衡浓度c(NH3)=2mol/L.
③下列叙述正确的是AB.
A.容器a达平衡时NH3的物质的量是0.5mol
B.容器b开始是向合成氨的逆反应方向进行
C.若容器a体积变为0.2L,则达平衡时放出的热量小于23.1kJ
D.不能利用已知数据计算容器b的平衡常数
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2 (g)+3H2 (g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
| A. | 当一个可逆反应达到平衡状态时,这个反应的正、逆反应速率相等 | |
| B. | 化学平衡状态是一种静止状态,因为反应物和生成物的浓度已经不再改变 | |
| C. | 当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的最大限度 | |
| D. | 化学反应的限度不可以通过改变条件而改变 |
| A. | 钠暴露在空气中,表面变暗,生成白色固体氧化钠 | |
| B. | 用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼的白光,放出大量的热,产生白色固体 | |
| C. | 铜的化学性质很稳定,铜在任何条件下都不会生锈 | |
| D. | 用坩埚钳夹住铁丝在酒精灯上加热红热,迅速伸进氧气瓶中,剧烈燃烧火星四射,放出大量的热,生成红棕色的固体 |
| A. | 实验室用KClO3制取氧气所剩余的KCl和MnO2的混合物 | |
| B. | 实验室用稀盐酸和大理石反应制取CO2时,得到的CaCl2和大理石的混合物 | |
| C. | 某同学用氢气还原氧化铜来制取纯净的铜,由于最后操作不当而使还原生成的铜部分被氧化后剩余的混合物 | |
| D. | 用过量的Zn粉和稀H2SO4溶液来制取H2最后剩余的混合物 |
| A. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | Fe(OH)3溶液氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ |
| A. | 常温常压下,8g O2含有0.5NA个氧原子 | |
| B. | 1L 0.1mol•L-1的Na2SO4溶液中有NA个Na+ | |
| C. | 标准状况下,22.4L CCl4含有NA个CCl4分子 | |
| D. | 1mol Al完全反应变成Al3+,失去2NA个电子 |
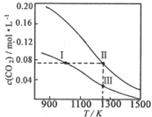 在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 状态Ⅱ和状态ⅢCO2的转化率相同 | |
| B. | 体系的总压强PⅢ:P总(状态Ⅱ)>2PⅠ (状态Ⅰ) | |
| C. | 反应的平衡常数:KⅠ>KⅡ=KⅢ | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ) |