题目内容
【题目】下列微粒中,最外层未成对电子数最多的是( )
A. SB. AsC. MnD. Fe3+
【答案】D
【解析】
根据能量最低原理书写各元素的电子排布式,根据电子排布式判断未成对电子数,据此进行解答。
A.S的最外层电子排布式为3s23p4,3p能级上有2个未成对电子;
B. As的最外层电子排布式为4s24p3,4p能级上有3个未成对电子;
C. Mn的最外层核外电子排布式为4s2,最外层未成对电子数为0;
D. Fe3+的最外层电子排布式为3s23p63d5,3d能级上有5个未成对电子;
根据分析可以知道最外层未成对电子数最多的是Fe3+,
所以D选项是正确的。

【题目】现有部分元素的原子结构特点如表:
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 最外层电子数是次外层电子数的2.5倍 |
(1)画出W原子结构示意图________________________。
(2)元素X与元素Z相比,非金属性较强的是________(填元素名称),写出一个能表示X、Z非金属性强弱关系的化学反应方程式:________________________________________。
(3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为____________________。
(4)元素X和元素Y以原子个数比1∶1化合形成的化合物Q,写出Q的电子式________。元素W和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的、且在自然界中稳定存在的物质,写出该反应的化学方程式:____________________________________。
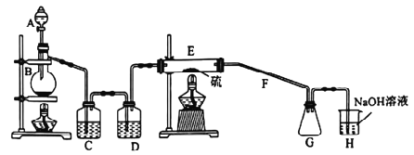
【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
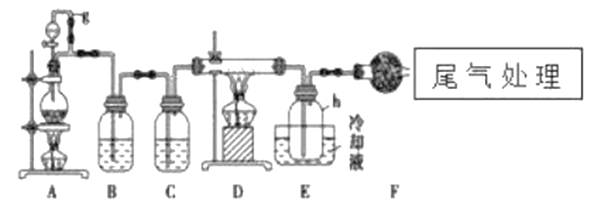
相关信息如下:
a.四氯化硅接触水会发生化学反应;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BC13 | A1C13 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:___________,D中发生反应的化学方程式___________。
(2)A中g管的作用是__________________,装置C中的试剂是___________,作用是___________。
(3)装置E中的h瓶需要冷却的理由是______________________。
(4)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是___________(填写元素符号)。
(5)过量的氯气可以用石灰乳来处理,请写出该反应的化学方程式_____________________。