题目内容
【题目】铜在生活中有广泛的应用。CuCl2和CuCl是两种常见的盐,广泛应用于工业生产.
I.CuCl2固体遇水易水解。实验室用如图所示的实验仪器及药品来制备纯净、干燥的氯气,并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。
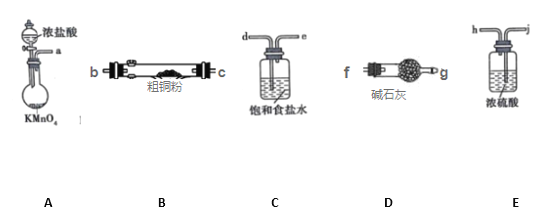
(1)写出装置A中,发生反应的化学反应方程式:_______________________________,装置C的作用是_______________________________
(2)完成上述实验,按气流方向连接各仪器接口的顺序是a→_________________________。(每种仪器限使用一次)
(3)上述D装置的作用是____________________
(4)实验完毕,取试管中的固体用盐酸溶解后,欲提纯氯化铜(原粗铜含杂质铁)可加入_________,并过滤。
A.Cu B.CuCO3 C.CuO D.NaOH
ⅡCuCl是应用广泛的有机合成催化剂,可采取不同方法制取。CuCl晶体呈白色,露置于潮湿空气中易被氧化。
方法一:向上述制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,写出该反应的离子方程式:_______________________________ 。
方法二 铜粉还原CuSO4溶液
![]()
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+ 2Cl-![]() [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)①中,“加热”温度不宜过高和过低,目的是_______________,当观察到_________________________________________________________________________________现象,即表明反应已经完全。
(2)②中,加入大量水的作用是______________。(从平衡角度解释)
(3)溶液中氯离子浓度达到一定量时,生成CuCl会部分溶解生成CuCl2-在一定温度下建立两个平衡: Cu Cl(s)![]() Cu+(aq) + Cl-(aq) Ksp=1.4x10-6 Cu Cl(s) + Cl一(aq)
Cu+(aq) + Cl-(aq) Ksp=1.4x10-6 Cu Cl(s) + Cl一(aq)![]() CuCl2-(aq) K=0.35
CuCl2-(aq) K=0.35
分析[Cu+]、[CuCl2-]和Ksp,K的数学关系,在图中画出「Cu+]、[CuCl2-]的函数关系曲线(要求至少标出曲线上一个坐标点)
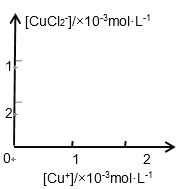 _______________
_______________
【答案】2KMnO4+16HCl=5Cl2↑+2KCl+8H2O+2MnCl2除去氯气中混有的HCld e j h (b c) g f吸收氯气防止尾气污染;防止空气中的水蒸气进入装置,使CuCl2水解BC2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-温度不能过低,防止反应速率慢;不能过高,过高HCl挥发溶液由蓝色变为无色稀释促进平衡Cu Cl(白色)+2Cl-
2CuCl↓+4H++SO42-温度不能过低,防止反应速率慢;不能过高,过高HCl挥发溶液由蓝色变为无色稀释促进平衡Cu Cl(白色)+2Cl- ![]() [ CuCl3] 2-(无色溶液)逆向移动,生成CuCl;
[ CuCl3] 2-(无色溶液)逆向移动,生成CuCl;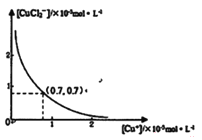
【解析】
I. (1)写出装置A中,发生反应的化学反应方程式为:2KMnO4+16HCl=5Cl2↑+2KCl+8H2O+2MnCl2,装置C装有饱和食盐水,其作用是除去氯气中混有的HCl;(2)从a出来的气体含有氯化氢和水蒸气,依次通过d e j h 除去氯化氢和水蒸气,然后与铜反应,最后尾气处理用氢氧化钠,则依次再通过b c g f,所以按照气流方向各仪器接口的连接顺序为a→d→e→j→h→b→c →g→f;(3)D装置中装有碱石灰,其作用是吸收氯气防止尾气污染;防止空气中的水蒸气进入装置,使CuCl2水解;(4)实验完毕,取试管中的固体用盐酸溶解后,欲提纯氯化铜(原粗铜含杂质铁)可加入CuO或CuCO3、Cu2(OH)2 CO3、.Cu(OH)2以消耗氢离子但不引入新的杂质,并过滤。答案选BC;
Ⅱ、向制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,同时生成硫酸,反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-;(1)温度不能过低,防止反应速率慢;不能过高,过高HCl挥发,故①中“加热”温度不宜过高和过低;当观察到溶液由蓝色变为无色,即表明反应已经完全;(2)②中,加入大量水的作用是稀释促进平衡Cu Cl(白色)+2Cl-
2CuCl↓+4H++SO42-;(1)温度不能过低,防止反应速率慢;不能过高,过高HCl挥发,故①中“加热”温度不宜过高和过低;当观察到溶液由蓝色变为无色,即表明反应已经完全;(2)②中,加入大量水的作用是稀释促进平衡Cu Cl(白色)+2Cl- ![]() [ CuCl3] 2-(无色溶液)逆向移动,生成CuCl;(3)根据①Cu Cl(s)
[ CuCl3] 2-(无色溶液)逆向移动,生成CuCl;(3)根据①Cu Cl(s)![]() Cu+(aq) + Cl-(aq) Ksp=1.4x10-6;②Cu Cl(s) + Cl一(aq)
Cu+(aq) + Cl-(aq) Ksp=1.4x10-6;②Cu Cl(s) + Cl一(aq)![]() CuCl2-(aq) K=0.35,①+②得2Cu Cl(s)
CuCl2-(aq) K=0.35,①+②得2Cu Cl(s) ![]() Cu+(a q)+ [CuCl2]- (a q) K=0.49×10-6,根据方程式可知:c(Cu+)·c([CuCl2]-)= 0.49×10-6,两离子浓度成反比,两离子浓度相同时为0.7×10-3mol/L,据此可画出图像为:
Cu+(a q)+ [CuCl2]- (a q) K=0.49×10-6,根据方程式可知:c(Cu+)·c([CuCl2]-)= 0.49×10-6,两离子浓度成反比,两离子浓度相同时为0.7×10-3mol/L,据此可画出图像为: 。
。

【题目】I.工厂采用含硫酸和氢氟酸的溶液作为矿物中稀有元素的萃取液,生产要求该萃取液中硫酸的浓度为3 mol/L,氢氟酸的浓度为8 mol/L。现有一批回收酸液共400 L,经测定其中氢氟酸浓度为12 mol/L,硫酸的浓度为1 mol/L。现要用此回收酸液配制上述萃取液,在400 L回收酸液中加入________________L(小数点后保留一位有效数字)密度为1.84 g/cm3、浓度为98%的浓硫酸,然后 ________,即可得到符合要求的萃取液。
II.某混合溶液中可能大量含有的离子如下表所示:
阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
阴离子 | Cl-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。
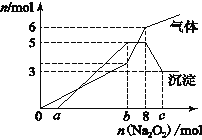
(1)该溶液中一定含有的阳离子是____________________,其对应物质的量浓度之比为___________________________,溶液中一定不存在的阴离子是_________________________。
(2)写出沉淀减少的离子方程式_____________________。


