题目内容
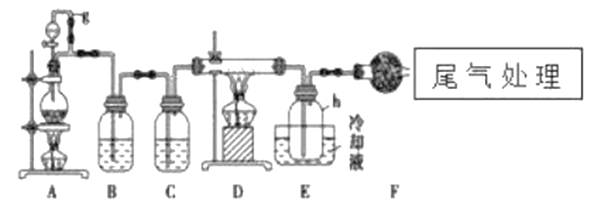
【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息如下:
a.四氯化硅接触水会发生化学反应;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BC13 | A1C13 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:___________,D中发生反应的化学方程式___________。
(2)A中g管的作用是__________________,装置C中的试剂是___________,作用是___________。
(3)装置E中的h瓶需要冷却的理由是______________________。
(4)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是___________(填写元素符号)。
(5)过量的氯气可以用石灰乳来处理,请写出该反应的化学方程式_____________________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 2Cl2+Si
MnCl2+Cl2↑+2H2O 2Cl2+Si![]() SiCl4 平衡气压 浓硫酸 干燥氯气 四氯化硅沸点低,需要冷凝收集 Al、P 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
SiCl4 平衡气压 浓硫酸 干燥氯气 四氯化硅沸点低,需要冷凝收集 Al、P 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
由制备四氯化硅的实验流程可知,A中发生二氧化锰与浓盐酸的反应生成氯气,B中饱和实验水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,E装置收集四氯化硅,F装置吸收空气中的水蒸气,防止四氯化硅接触水会发生化学反应,据此解答。
(1)装置A制备氯气,实验室利用浓盐酸和二氧化锰加热制备氯气,则其中发生反应的离子方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,D中发生Si与氯气的反应生成四氯化硅,则D中发生反应的化学方程式为2Cl2+Si
MnCl2+Cl2↑+2H2O,D中发生Si与氯气的反应生成四氯化硅,则D中发生反应的化学方程式为2Cl2+Si![]() SiCl4。
SiCl4。
(2)A中g管可以使内外压强相等,便于液体顺利流下;生成的氯气中混有氯化氢和水蒸气,首先利用饱和食盐水除去氯化氢,最后干燥氯气,则装置C中的试剂是浓硫酸,作用是干燥氯气。
(3)根据表中数据可知四氯化硅沸点低,因此装置E中的h瓶需要冷却的理由是冷凝收集四氯化硅。
(4)根据表中数据可知BCl3、FeCl3、PCl5的熔点很低,则精馏后的残留物中,除铁元素外可能还含有的杂质元素是B、P。
(5)过量的氯气可以用石灰乳来处理,该反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案