题目内容
16.下列现象中,不能用有关胶体的知识解释的是( )| A. | 豆浆中加入石膏做豆腐 | |
| B. | 在河流入海口处易形成三角洲 | |
| C. | 在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 | |
| D. | 清晨的阳光穿过茂密的林木枝叶产生美丽的光线 |
分析 A.胶体遇电解质发生聚沉;
B.江河入海口三角洲的形成是胶体聚沉的结果;
C.FeCl3溶液中加入NaOH溶液生成沉淀;
D.气溶胶具有丁达尔现象.
解答 解:A.豆浆是胶体,遇电解质发生聚沉,故A正确;
B.江河中的泥浆属于胶体,江河入海口三角洲的形成是胶体聚沉的结果,故B正确;
C.FeCl3溶液中加入NaOH溶液发生反应生成氢氧化铁沉淀,与胶体无关,故C错误;
D.清晨的阳光穿过茂密的林木枝叶所产生的美丽景象,是胶体的丁达尔现象,与胶体有关,故D正确.
故选C.
点评 本题考查胶体的性质,难度较小,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.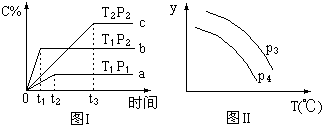 在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
 在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )| A. | P3>P4,y轴表示A的物质的量 | |
| B. | P3<P4,y轴表示B的体积分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3>P4,y轴表示混合气体的平均相对分子质量 |
4.部分弱酸的电离平衡常数如下表:
下列选项错误的是( )
| 弱酸 | HA | HB | H2C |
| 电离平衡常数 (25℃) | K1=1.77×10-4 | K1=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | B-+HA→HB+A- | |
| B. | 2Bˉ+H2C→2HB+C2- | |
| C. | 中和等体积、等pH的HA和HB消耗NaOH的量前者小于后者 | |
| D. | 等体积、等浓度的NaA和NaB溶液中所含离子总数前者大于后者 |
11.向含0.2mol AlCl3的溶液中加入了一定量的1mol/L的NaOH溶液后,生成了7.8g的沉淀,则加入的NaOH溶液的体积为( )
| A. | 150 mL | B. | 200 mL | C. | 300 mL | D. | 400 mL |
1.某无色溶液与NaHCO3 作用能产生气体,此溶液中可能大量共存的离子组是( )
| A. | Na+、Ba2+、NO3-、SO42- | B. | Cl-、K+、H+、SO42- | ||
| C. | Na+、Cl-、K+、Ag+ | D. | Fe2+、SO42-、OH-、Na+ |
8.部分短周期元素的性质或原子结构如下表所示:
(1)用化学用语回答下列问题:
①A元素在周期表中的位置第三周期第ⅥA族.
②用电子式表示A和B元素组成的化合物的形成过程 .
.
(2)元素D与元素A相比,D的非金属性较强,下列表述能证明这一事实的是ad(填选项符号).
a.D的氢化物比A的氢化物稳定
b.常温下D的单质和A的单质状态不同
c.一定条件下D和A的单质都能与钠反应
d.D的最价氧化物对应的水化物酸性强于A的最价氧化物对应的水化物的酸性
(3)X是由A、B、C、D四种元素中的某种元素形成的单质,能经如图所示的过程转化为W(其他条件略去).
X$\stackrel{{O}_{2}}{→}$Y$\stackrel{{O}_{2}}{→}$Z$\stackrel{{H}_{2}O}{→}$W
①若Z是红棕色气体,则 Z $\stackrel{H_{2}O}{→}$ W 的化学方程式为3NO2+H2O=2HNO3+NO,此反应中氧化剂与还原剂的物质的量之比是1:2.
②若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,再滴加适量H2O2 溶液,有白色沉淀生成,生成该白色沉淀的化学方程式为BaCl2+SO2+H2O2=BaSO4↓+2HCl.
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
①A元素在周期表中的位置第三周期第ⅥA族.
②用电子式表示A和B元素组成的化合物的形成过程
 .
.(2)元素D与元素A相比,D的非金属性较强,下列表述能证明这一事实的是ad(填选项符号).
a.D的氢化物比A的氢化物稳定
b.常温下D的单质和A的单质状态不同
c.一定条件下D和A的单质都能与钠反应
d.D的最价氧化物对应的水化物酸性强于A的最价氧化物对应的水化物的酸性
(3)X是由A、B、C、D四种元素中的某种元素形成的单质,能经如图所示的过程转化为W(其他条件略去).
X$\stackrel{{O}_{2}}{→}$Y$\stackrel{{O}_{2}}{→}$Z$\stackrel{{H}_{2}O}{→}$W
①若Z是红棕色气体,则 Z $\stackrel{H_{2}O}{→}$ W 的化学方程式为3NO2+H2O=2HNO3+NO,此反应中氧化剂与还原剂的物质的量之比是1:2.
②若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,再滴加适量H2O2 溶液,有白色沉淀生成,生成该白色沉淀的化学方程式为BaCl2+SO2+H2O2=BaSO4↓+2HCl.
5.能正确表示下列反应的离子方程式是( )
| A. | 碳酸氢钙溶液和氢氧化钠溶液混合 HCO3-+OH-═CO32-+H2O | |
| B. | 醋酸钠溶液和盐酸混合 CH3COONa+H+═CH3COOH+Na+ | |
| C. | 少量金属钠放入冷水中 Na+2H2O═Na++2OH-+H2↑ | |
| D. | 硫酸铜溶液和氢氧化钡溶液混合 Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ |
6.下列叙述都涉及化学相关知识,其中正确的是( )
| A. | 将置于海水中的钢铁设备作为阴极,接上直流电源和辅助阳极,使其受到保护的方法叫牺牲阳极的阴极保护法 | |
| B. | 200mlmol/LFe2(SO4)3溶液,Fe3+和SO42-,离子总数为NA | |
| C. | 10g 46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| D. | 可用电解氯化镁溶液的方法制取金属镁 |