题目内容
镁、铝、铁及其化合物在生产和生活中有广泛的应用。
(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg): n(Al)= 。
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料。取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为 。
(3)现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是 。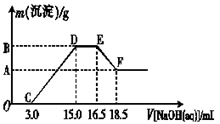
(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为 (最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
则该硫酸溶液的物质的量浓度为 。
③若在上述实验Ⅱ中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为 g (保留3位小数)
(1)1:2 (2分)
(2)78%(2分)
(3)0.856(2分)
(4)①50∶1
②1.25 mol/L
③ (m+5.624)×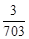 g)
g)
解析试题分析:
(1)解:设Mg和Al的物质的量为x和y
Mg+H2SO4 ="Mg" SO4+ H2↑ 2 Al+3H2SO4 = Al2 (SO4)3+ 3H2↑
x x 2 3
y 3/2 y
x+ 3/2 y =0.2 24 x+ 27*y=3.90 x=0.05 y=0.1
答:镁铝合金中物质的量n(Mg): n(Al)= 0.05: 0.1=1:2
(2)解:设FeS2的质量为x
4FeS2 +11O2=2Fe2O3 +8SO2 ⊿m
4*120 (4*120-2*160)
x (10-7.4)
x=7.8
答:硫铁矿中FeS2的质量分数为7.8*100%/10=78%
(3)设HN O3的物质的量浓度为x;Al的物质的量为y;Fe的物质的量为z
OC段:HN O3——--NaOH EF段:Al-----Al(OH)3——----- NaOH——------Na AlO2
100x 4*3 y 4*(18.5-16.5)/1000
x=0.12 y=0.008
CD段: Al——3 OH———Al(OH)3 Fe—— 3 OH———Fe(OH)3
3 1 3 1
0.024 0.008 4*(15-3)/1000-0.024 0.008
A点沉淀是氢氧化铁,质量为: 107*0.008=0.856(g)
(4)①nCO2= 0.224/22.4=0.01(mol)
C—— CO2
0.01 0.01 nFe=(28.12-0.01*12)/56=0.5(mol)
此钢样粉末中铁和碳的物质的量之比为 nFe:nC=0.5: 0.01=50∶1
②由表可知:Ⅲ钢样过量,由氢气量可求硫酸的量,n H2=2.8/22.4=0.125(mol)
H2SO4------ H2
0.05
该硫酸溶液的物质的量浓度为C=n/V=0.125/0.1=1.25( mol/L)
③(设恰好溶解时钢样的质量为x,对于实验I和III,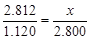 x=7.030g
x=7.030g
此时加入的钢样的质量为m=7.030-5.624=1.406g
①当钢样粉末中的铁未全部溶解时,即m>1.406g
反应结束后剩余固体的质量为m+5.624-0.125×56=(m-1.376)g
②当钢样粉末中的铁全部溶解时,即m≤1.406g
反应结束后剩余固体的质量为 (m+5.624)×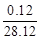 g 或 (m+5.624)×
g 或 (m+5.624)×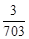 g)
g)
考点:本题以实验为基础,考查化学计算等知识。

实验室要用98%(密度为1.84g.cm-3)的硫酸配制3.68mol/L的硫酸溶液480mL。
(1)需准确量取98%的硫酸 mL。
(2)要配制3.68mol/L的硫酸溶液480mL,必须用到的仪器是烧杯、玻璃棒、量筒
(3)若配制3.68mol/L的硫酸溶液的其它操作均正确,但出现下列错误操作,将使所配制的硫酸溶液浓度偏低的是 。
| A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 |
| B.将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外 |
| C.用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切 |
| D.用胶头滴管向容量瓶中加水时,仰视观察溶液凹液面与容量瓶刻度相切 |
下图是硫酸试剂瓶标签上的内容。
| 硫酸:化学纯(CP)(500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g·cm-3 质量分数:98% |
(2)实验室用该硫酸配制240mL 0.46mol/L的稀硫酸,则
①有以下仪器: A.烧杯 B.100mL量筒 C.250mL容量瓶 D.500mL容量瓶 E.玻璃棒 F.托盘天平(带砝码)G.10mL量筒H.胶头滴管,配制时,必须使用的仪器有 (填代号).
②需要该硫酸的体积为 mL.
③下图为配制过程中的几个关键步骤和操作:将上述实验步骤A—F按实验过程
先后次序排列 。
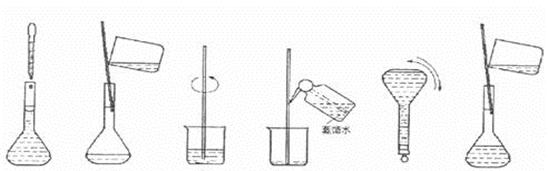
|
④该同学实际配制得到的浓度为0.45mol/L,可能的原因是
A.量取浓H2SO4时仰视刻度
B.容量瓶洗净后未经干燥处理
C.没有将洗涤液转入容量瓶
D.定容时仰视刻度
下列各组物质的分类都正确的是(括号里的是类别)
| A.空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质) |
| B.液氨(氢化物)、NH4Cl(铵盐)、HNO3(含氧酸)、NaOH(强电解质) |
| C.HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃) |
| D.NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯) |
 NaHSO4 + HCl↑,现有117g NaCl晶体和足量的浓硫酸完全反应。求:
NaHSO4 + HCl↑,现有117g NaCl晶体和足量的浓硫酸完全反应。求: 4NO+6 H2O,4NO+3O2+2H2O
4NO+6 H2O,4NO+3O2+2H2O 4HNO3
4HNO3