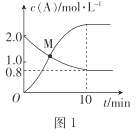
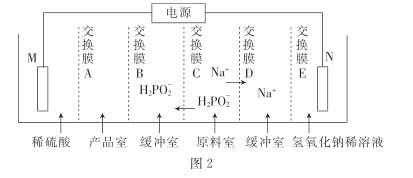
题目内容
【题目】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
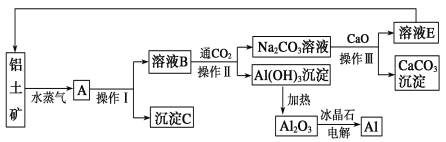
请回答下列问题:
(1)沉淀C的化学式为____,C与金属Al可以在高温下发生反应,可用于焊接铁轨。则该反应的化学方程式为_________。
(2)操作Ⅰ、操作Ⅱ 和操作Ⅲ 都是____(填操作名称),实验室要洗涤Al(OH)3沉淀,洗涤方法是____________。
(3)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有______(填化学式)。用此法制取铝的副产品是______(填化学式)。
(4)金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:![]() ,电解熔融的氧化铝,若得到标准状况下11.2 L O2,则同时生成____g铝。
,电解熔融的氧化铝,若得到标准状况下11.2 L O2,则同时生成____g铝。
下列有关此工艺的说法合理的是______
A.冰品石(Na3AlF6)的作用是降低Al2O3的熔化温度
B.电解生成的金属铝是在熔融液的上层
C.电解过程中的电极材料可以为金属材料
D.铝是高耗能产品,废旧铝材的回收后制成氧化铝比较合理
(5)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:___(填化学式)。
【答案】Fe2O3 2Al+ Fe2O3=Al2O3 +2Fe 过滤 向漏斗中加蒸馏水至浸没沉淀,使水自然流完,重复操作2~3次 CaO和CO2 Fe2O3和O2 18 A SiO2
【解析】
根据流程图,氧化铝可以和氢氧化钠反应得到偏铝酸钠,氧化铁和氢氧化钠不反应,所以B是偏铝酸钠溶液,C是氧化铁,实现固体和液体的分离的方法是过滤,氢氧化铝受热分解得到氧化铝和水,电解氧化铝得到的是金属铝和氧气,据流程分析解题。
(1)因Al2O3+2NaOH═2NaAlO2+H2O,而Fe2O3不与NaOH溶液发生反应,因此过滤得到的沉淀C为Fe2O3,利用Fe2O3发生铝热反应制取Fe,即2Al+Fe2O3![]() Al2O3+2Fe;
Al2O3+2Fe;
(2)操作Ⅰ、Ⅱ、Ⅲ均是除去不溶于液体的固体,即过滤,洗涤方法是向漏斗中加蒸馏水至浸没沉淀,使水自然流完,重复操作2~3次;
(3)据流程图可看出循环使用的物质除NaOH、H2O外,还有CaCO3![]() CaO+CO2↑,CaO与CO2也可循环使用;制取Al同时得到Fe2O3和O2;
CaO+CO2↑,CaO与CO2也可循环使用;制取Al同时得到Fe2O3和O2;
(4)2Al2O3(熔融)![]() 4Al+3O2↑,n(O2)=0.5mol,则m(Al)=
4Al+3O2↑,n(O2)=0.5mol,则m(Al)=![]() ×0.5mol×27g/mol=18g;
×0.5mol×27g/mol=18g;
A.Al2O3的熔点很高,熔化得需要较多能量,加入冰晶石可以降低熔化温度,故A正确;
B.由于冰晶石(Na3AlF6)与氧化铝熔融物密度比铝的小,所以铝在熔融液的下层,故B错误;
C.电解过程中如果是金属做阳极,将参与电极反应,故C错误;
D.电解产生的铝要尽量以单质形式存在,所以将回收铝做成铝锭最好,故D错误;
故答案为:A;
(5)铝土矿中含有二氧化硅,可以和氢氧化钠反应生成硅酸钠溶液,向其中通二氧化碳可以得到硅酸沉淀,硅酸受热分解得到二氧化硅,所以生产过程中得到的氧化铝将混有杂质二氧化硅。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案