题目内容
【题目】工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性:Fe+5CO═Fe(CO)5。为了防止催化剂铁触媒中毒,要除去CO,发生的反应为Cu(NH3)2OOCCH3+CO+NH3═Cu(NH3)3(CO)OOCCH3。回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最低的是______(填字母序号)。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(2)写出CO的一种常见等电子体的结构式:_______;C、N、O的电负性由大到小的顺序为______(用元素符号表示)。
(3)与O同族的元素还有S、Se、Te,它们简单氢化物的沸点从高到低的顺序为______,其原因为______。
(4)配合物[Cu(NH3)2]OOCCH3中,铜显+1价, [Cu(NH3)2]+中中心离子的电子排布式为______,其中碳原子的杂化轨道类型是______,NH3分子的VSEPR模型为______。
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:
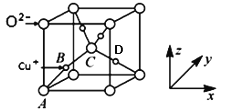
①若以A点为原点建立坐标系,A的坐标为(0,0,0),B的坐标为(![]() ),则D的坐标为______;
),则D的坐标为______;
②若阿伏加德罗常数为NA,该晶胞的边长为a pm,则晶体的密度为______gcm-3。
【答案】a N≡N O>N>C H2O>H2Te>H2Se>H2S H2Te、H2Se、H2S均是分子晶体,相对分子质量逐渐减小,范德华力减小,所以沸点减小,而水分子中存在氢键,所以沸点最高 [Ar]3d10 sp3、sp2 四面体形 (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】
(1)轨道中电子能量:1s<2s<2p,能量较高的轨道中电子越多,该微粒能量越高,所以2p轨道上电子越多、1s轨道上电子越少,该微粒能量越高,根据图知能量由低到高的顺序是a<b<c<d,所以能量最低的为a;
(2)等电子体为原子总数相同,价电子总数也相同的微粒,与CO互为等电子体的一种分子为N2,其结构式为:N≡N;同周期主族元素,随着原子序数增大,第一电离能呈增大的趋势,但N原子的2p能级为半满状态,更稳定,第一电离能较大,所以C、N、O的第一电离能由大到小的顺序为:N>O>C;
(3)H2Te、H2Se、H2S均是分子晶体,结构相似,相对分子质量逐渐减小,范德华力减小,所以沸点依次减小,但水分子间存在氢键,氢键的作用力比范德华力强,氢键会使沸点异常升高,导致H2O的沸点异常的高,所以沸点大小为H2O>H2Te>H2Se>H2S;
(4)[Cu(NH3)2]+中中心离子为Cu+,Cu元素为29号元素,失去最外层一个电子形成Cu+,所以Cu+的核外电子排布为[Ar]3d10;甲基中碳原子形成4个σ键,没有孤电子对,杂化轨道数目为4,碳原子杂化方式为sp3,而羰基中C原子形成3个σ键,没有孤电子对,杂化轨道数目为3,碳原子杂化方式为sp2;NH3中N原子形成3个N-H键,含有1对孤对电子,价层电子对数=3+1=4,VSEPR模型为四面体形;
(5)①根据B点坐标可知D点在底面的投影应位于底面对角线的![]() 处,所以其x、y坐标均为
处,所以其x、y坐标均为![]() ,其纵坐标与B相同,所以D的坐标为(
,其纵坐标与B相同,所以D的坐标为(![]() ,
,![]() ,
,![]() );
);
②根据晶胞结构可知晶胞中Cu+的个数为4,化学式为Cu2O,所以O2-的个数为2,则晶胞的质量m=![]() g,晶胞的边长为a pm,所以晶胞的体积为V=a3pm3=(a×10-10)3cm3,所以晶体的密度为
g,晶胞的边长为a pm,所以晶胞的体积为V=a3pm3=(a×10-10)3cm3,所以晶体的密度为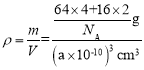 =
=![]() g·cm3。
g·cm3。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案【题目】芳香酸是分子中羧基与苯环直接相连的一类有机物,通常用芳香烃的氧化来制备。反应原理如下:
![]() +2KMnO4
+2KMnO4![]() +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() +HCl
+HCl![]() +KCl
+KCl
反应试剂、产物的物理常数:
名称 | 相对分子质量 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) | 水中的溶解性 |
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 |
主要实验装置和流程如图:
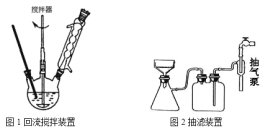
实验方法:一定量的甲苯和KMnO4溶液加入图1装置中,在90℃时,反应一段时间后,停止反应,按如图流程分离出苯甲酸并回收未反应的甲苯。
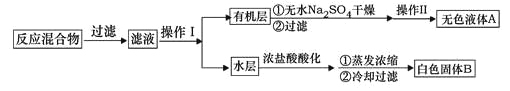
(1)白色固体B中主要成分的分子式为______,操作Ⅱ为______。
(2)下列关于仪器的组装或者使用正确的是______。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.如图回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是上进下出
(3)除去残留在苯甲酸中的甲苯应先加入______,分液,然后再向水层中加入______,抽滤,洗涤,干燥即可得到苯甲酸。
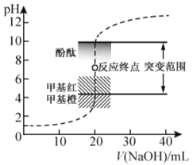
(4)纯度测定:称取2.440g产品,配成100mL溶液,取其中25.00mL溶液,行滴定,消耗KOH物质的量为4.5×10-3mol。产品中苯甲酸质量分数为______。
【题目】分别进行下表所示实验,实验现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 测量熔融状态下NaHSO4的导电性 | 能导电 | 熔融状态下NaHSO4能电离出Na+、H+、 |
B | 蘸有浓氨水的玻璃棒靠近X | 有白烟产生 | X可能为浓盐酸 |
C | 将甲烷与氯气按体积比1:4混合于试管中光照 | 反应后混合气体能使润湿的石蕊试纸变红 | 生成的氯代甲烷具有酸性 |
D | 将AlCl3溶液加热蒸干 | 得到白色固体 | 白色固体成分为纯净的AlCl3 |
A.AB.BC.CD.D
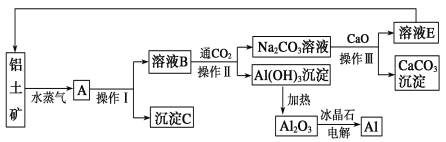
【题目】以SO2、软锰矿(主要成分为MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4液和Mn3O4,主要实验步骤如下
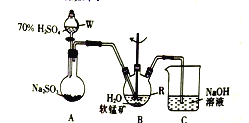
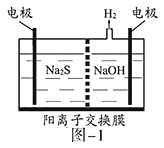
步骤I、如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2=MnSO4)。
步骤II、充分反应后,在不断搅拌下依次向仪器R中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅,
步骤III、过滤得MnSO4溶液
(1)仪器R的名称是_______。
(2)装置A用于制取SO2,反应的化学方程式为_________。
(3)装置B中的反应应控制在90~100℃,适宜的加热方式是______________。
(4)装置C的作用是______________________。
(5)“步骤Ⅱ”中加入纯净MnO2的目的是_______________,用MnCO3调节溶液pH时,需调节溶液pH的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下表)
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀的pH | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全的pH | 9.18 | 3.27 | 4.9 | 10.2 |
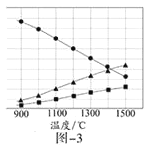
(6)已知①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示

②反应温度超过80℃时,Mn3O4的产率开始降低,Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:______________________,真空干燥6小时得产品Mn3O4。